

| NaOH溶液的体积/mL | 16.00 | |||
| 样品的质量/g | 3.1 | 6.2 | 9.3 | 12.4 |
| 氨气的质量/g | 0.748 | 0.748 | 0.680 | a |
| ||
| ||
| 0.748g |
| 17g/mol |
| 0.68g |
| 17g/mol |
| 0.052mol |
| 0.016L |


科目:高中化学 来源: 题型:
| A、推广使用无磷洗涤剂 |
| B、推广垃圾分类存放、回收和处理 |
| C、提倡使用手帕,减少餐巾纸的使用 |
| D、提倡使用一次性塑料餐具和塑料袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 110.0 | 169 | 246 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 45.5 | 51.1 | 56.7 |
| NaNO3 | 73 | 80 | 88 | 96 | 104 | 124 | 148 | 180 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

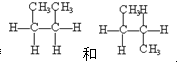


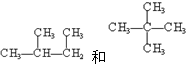




查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族; E是无色溶液.在适当的条件下,它们可以按下面框图进行反应.
下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族; E是无色溶液.在适当的条件下,它们可以按下面框图进行反应.查看答案和解析>>
科目:高中化学 来源: 题型:
 ③CH3CHO、④CH3COOH中,俗称醋酸的是
③CH3CHO、④CH3COOH中,俗称醋酸的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com