
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③⑥⑦B.①④⑥⑦C.②③④⑦D.①②④⑥
【答案】B
【解析】
在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,利用化学平衡状态的特征"等”、“定”来判断反应达到平衡状态。
①、单位时间内生成nmolO2的同时生成2n molNO2,说明正逆反应速率的相等,该反应达到平衡状态,故①正确;
②、单位时间内生成nmolO2的同时生2n molNO,只能说明单方向关系,不能说明正逆反应速率的关系,故②错误;
③、用NO2、NO、O2表示的反应速率的比为2:2:1的状态,反应进行到任何时刻都成立的关系,不能说明达到了平衡,故③错误;
④、混合气体的颜色不变化,说明二氧化氮的浓度不变化,该反应达到平衡状态,故④正确;
⑤、该反应是一个反应前后气体的质量不会改变的化学反应,混合气体的质量是守恒的,容器的体积不变,导致混合气体的密度不再变化,所以该反应不一定达到平衡状态,故⑤错误;
⑥、因该反应是物质的量在增大的化学反应,物质的量与压强成正比,则混合气体的压强不随时间的变化而变化,达到平衡状态,故⑥正确;
⑦、混合气体的平均相对分子质量=![]() ,混合气体的总质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,故⑦正确;
,混合气体的总质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,故⑦正确;
故选B。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示:
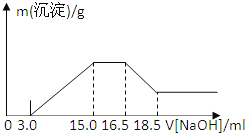
下列结论正确的是( )
A.铝与混合溶液反应的离子方程式为8Al+30H++3NO3=8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4:3
D.混合液中硫酸的物质的量的浓度为0.72 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
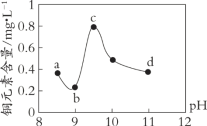
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I (aq)![]() (aq)。该反应的化学平衡常数K 随着温度的升高而减小。下列说法正确的是( )
(aq)。该反应的化学平衡常数K 随着温度的升高而减小。下列说法正确的是( )
A.反应 I2(aq)+I (aq)![]() (aq)的 ΔH>0
(aq)的 ΔH>0
B.利用上述反应,可以在碘量法滴定过程中加入过量 KI 以减少 I2 的挥发损失
C.在 I2 的 KI 溶液中加入CCl4,平衡不移动
D.一定温度下,向 I2 的KI 溶液中加入少量 KI 固体,化学平衡正向移动,平衡常数K 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为________;基态Cu+的核外电子排布式为___________。
(2)化合物(CH3)3N分子中N原子杂化方式为________,该物质能溶于水的原因是______。
(3)PH3分子的键角小于NH3分子的原因是________________;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为______________________。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:

①在一个晶胞中原子的配位数为_______________。
②已知磷化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA,则B-P键长为_________。
③磷化硼晶胞沿着体对角线方向的投影如图,请在答题卡上将表示B原子的圆圈涂黑_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为:铝土矿![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3![]() 无水AlCl3
无水AlCl3![]() Al
Al
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L1的HA溶液中逐滴加入0.1mol·L1的NaOH溶液,溶液中水所电离的c水(H+)随加入NaOH溶液体积的变化如图所示,下列说法正确的是
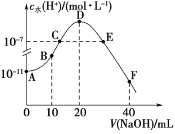
A.HA的电离常数Ka约为1×105
B.B点的溶液中粒子浓度满足关系:c(HA)>c(Na+)>c(A)
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度满足关系c(OH)=c(HA)+c(A)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为Cu、
外,还含有少量稀贵金属,主要物质为Cu、![]() 和
和![]() 。某铜沉淀渣的主要元素质量分数如下:
。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数 |
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
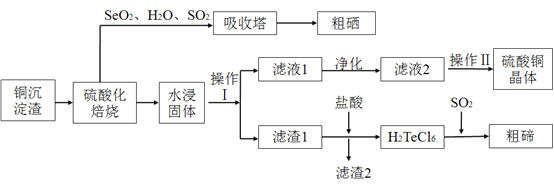
![]() 经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:
经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:![]() ____
____![]()
![]()
![]() ____
____![]() ____
____![]() ____
____![]()
![]() 与吸收塔中的
与吸收塔中的![]() 反应生成亚硒酸。焙烧产生的
反应生成亚硒酸。焙烧产生的![]() 气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
![]() 沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
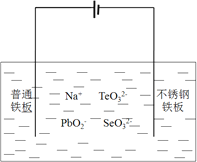
![]() 目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com