
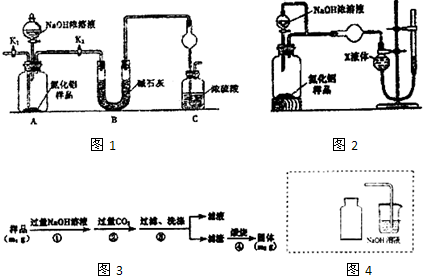

分析 (1)氨气是和浓硫酸能发生反应的气体,易发生倒吸,C装置中球形干燥管可以防止倒吸;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
(4)氨气极易溶于水,量气装置中的X液体不能与氨气反应,不能使氨气溶解;
(5)依据AlN+NaOH+H2O═NaAlO2+NH3↑在定量关系计算;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成;
(7)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高;
(8)铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图.
解答 解:(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,故答案为:防止倒吸;
(2)组装好实验装置,原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,故答案为:C装置出口处连接一个干燥装置;
(4)a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确;
故选ad;
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AlN+NaOH+H2O═NaAlO2+NH3↑
41 22.4L
m V×10-3L
m=$\frac{41V×1{0}^{-3}}{22.4}$
则AlN的质量分数=$\frac{41V×1{0}^{-3}}{22.4m}$×100%=$\frac{41V}{22400m}$×100%,
故答案为:$\frac{41V}{22400m}$×100%;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(7)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高;
(8)铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图为 ,故答案为:
,故答案为: .
.
点评 本题考查了物质性质的探究实验设计和实验分析判断,实验基本操作和物质性质的掌握是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键 | |
| D. | 分子间作用力越大,分子的热稳定性就越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有共价键形成的分子一定是共价化合物 | |
| B. | 含有金属阳离子的晶体一定是离子晶体 | |
| C. | 元素的非金属性越强,其单质的活泼性一定越强 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 | |
| C. | 工业冶炼铝时电解Al2O3并加入冰晶石(Na3AlF6),是为了降低Al2O3的熔融温度 | |
| D. | 洗衣粉中添加三聚磷酸钠,增强去污的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
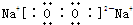 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H16与甲烷互为同系物 | |
| B. | 乙烯只能加成、不能取代,苯只能取代、不能加成 | |
| C. | CH3CH2CH2CH3和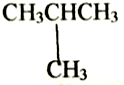 互为同分异构体 互为同分异构体 | |
| D. | 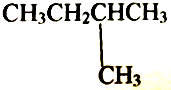 和 和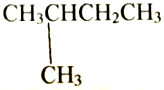 互为同分异构体 互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com