
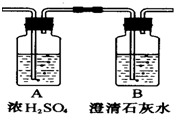
 燃烧法是测定有机化合物化学式的一种重要方法.
燃烧法是测定有机化合物化学式的一种重要方法.分析 (1)根据浓硫酸具有吸水性,增重10.8g为水的质量,石灰水增重的质量为二氧化碳的质量,计算水、二氧化碳的物质的量,根据元素守恒确定烃的分子式;
(2)若已知某烃为乙烯的同系物,燃烧生成二氧化碳与水的物质的量之比为1:1,完全燃烧后的产物通入盛有足量过氧化钠的干燥管,发生反应:2Na2O2+2CO2=O2+Na2CO3,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=4NaOH+O2,固体增重相当于与H2O等物质的量的氢气的质量,根据干燥管质量增重计算二氧化碳、水的物质的量,再根据C、H原子守恒确定烃的分子式,书写可能的结构简式.
解答 解:(1)浓硫酸具有吸水性,增重10.8g为水的质量,则n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,n(H)=2n(H2O)=2×0.6mol=1.2mol,所以该烃分子中H原子个数为$\frac{1.2mol}{0.1mol}$=12,
石灰水增重的22g质量为二氧化碳的质量,则n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(C)=n(CO2)=0.5mol,
即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为$\frac{0.5mol}{0.1mol}$=5,
所以该烃的分子式为C5H12,
答:该烃的化学式C5H12;
(2)若已知某烃为乙烯的同系物,燃烧生成二氧化碳与水的物质的量之比为1:1,完全燃烧后的产物通入盛有足量过氧化钠的干燥管,发生反应:2Na2O2+2CO2=O2+Na2CO3,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=4NaOH+O2,固体增重相当于与H2O等物质的量的氢气的质量,设二氧化碳、水的物质的量均为xmol,则x mol×28g/mol+xmol×2g/mol=45,故x=1.5,该烃分子中C原子数目为$\frac{1.5mol}{0.5mol}$=3,H原子数目为$\frac{1.5mol×2}{0.5mol}$=6,故该烃分子式为C3H6,结构简式为:CH2=CH-CH3,与溴的四氯化碳溶液反应的化学方程式为CH2=CH-CH3+Br2→BrCH2CHBrCH3,
答:该烃分子式为C3H6,结构简式为:CH2=CH-CH3,与溴的四氯化碳溶液反应的化学方程式为CH2=CH-CH3+Br2→BrCH2CHBrCH3.
点评 本题考查有机物分子式确定的计算,(2)中注意利用差量法理解二氧化碳、水与过氧化钠反应固体增重问题,侧重考查学生分析计算能力,难度中等.


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:解答题
| A | B | ||
| C | D | E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的水分子中含有18O | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成 45g 乙酸乙酯 | D. | 不可能生成 90g 乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| C. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N60与N2是同素异形体 | B. | N60一定是比N2更稳定的分子 | ||
| C. | N60的相对分子质量为840 | D. | N60可能是一种很好的火箭燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com