
超音速飞机在平流层飞行时,尾气中的![]() 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的![]() 和
和![]() 转变成
转变成![]() 和
和![]() ,化学方程式如下:
,化学方程式如下:
![]()
![]()
![]() 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
![]()
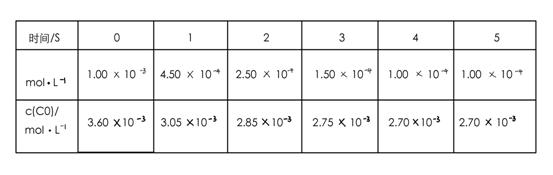
![]()
![]() 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
![]() (1)在上述条件下反应能够自发进行,则反应的
(1)在上述条件下反应能够自发进行,则反应的![]() 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。
![]() (2)前2s内的平均反应速率v(N2)=_____________。
(2)前2s内的平均反应速率v(N2)=_____________。
![]() (3)在该温度下,反应的平衡常数K= 。
(3)在该温度下,反应的平衡常数K= 。
![]() (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
![]() A.选用更有效的催化剂 B.升高反应体系的温度
A.选用更有效的催化剂 B.升高反应体系的温度
![]() C.降低反应体系的温度 D.缩小容器的体积
C.降低反应体系的温度 D.缩小容器的体积
![]() (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
![]()

![]() ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。
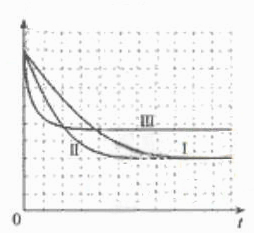
![]() ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
(1)< (2) 1.88×10-4mol/(L·s) (3)5000 (4)C、D
![]() (5)①II: 280、1.20×10-3、5.80×10-3
(5)①II: 280、1.20×10-3、5.80×10-3
![]() Ⅲ:1.2×10-3 、5.80×10-3
Ⅲ:1.2×10-3 、5.80×10-3
![]() ②
②
![]()
(1)自发反应,通常为放热反应,即DH小于0。(2)以NO计算,2s内NO的浓度变化为(10-2.5)×10-4mol/L,V(NO)=7.5×10-4/2 =3.75×10-4mol/(L·s)。根据速率之比等于计量系数比可知,V(N2)=1/2 V(NO)=1.875×10-4mol/(L·s)。(3)![]() =
=
![]()
![]() =5000。(4)催化剂不影响平衡的移动,A项错;该反应放热,故降温平衡正向移动,NO转化率增大,B项错,C项正确;缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确。(5)本题为实验探究题,目的是研究温度和催化剂的比表面积对速率的影响,研究时只能是一个变量在起作用,所以II中数据与I比较催化剂的比表面积增大了,故其他的数据应与I完全相同;III中数据与II比较,催化剂的比表面积数据未变,但是温度升高,故其他数据是不能改变的。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。作图,可根据先拐先平的原则,即最里面的线先达平衡,速率快,应对应于III(因为其温度和催化剂的比表面积是三组中最高的),II比I快,因为两组温度相同,但是II中催化剂的比表面积大。
=5000。(4)催化剂不影响平衡的移动,A项错;该反应放热,故降温平衡正向移动,NO转化率增大,B项错,C项正确;缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确。(5)本题为实验探究题,目的是研究温度和催化剂的比表面积对速率的影响,研究时只能是一个变量在起作用,所以II中数据与I比较催化剂的比表面积增大了,故其他的数据应与I完全相同;III中数据与II比较,催化剂的比表面积数据未变,但是温度升高,故其他数据是不能改变的。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。作图,可根据先拐先平的原则,即最里面的线先达平衡,速率快,应对应于III(因为其温度和催化剂的比表面积是三组中最高的),II比I快,因为两组温度相同,但是II中催化剂的比表面积大。


科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 |
T(℃) | NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 280 |
1.20×10-3 1.20×10-3 |
5.80×10-3 5.80×10-3 |
124 |
| Ⅲ | 350 | 1.20×10-3 1.20×10-3 |
5.80×10-3 5.80×10-3 |
124 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) |
1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) |
3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| C(N2)C2(CO2) |
| C2(CO)C2(NO) |
| C(N2)C2(CO2) |
| C2(CO)C2(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| 实验 编号 |
T(℃) | NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 280 |
1.20×10-3 1.20×10-3 |
1.20×10-3 1.20×10-3 |
124 |
| Ⅲ | 350 | 5.80×10-3 5.80×10-3 |
5.80×10-3 5.80×10-3 |
124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com