
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)=c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L
C
【解析】
试题分析:取0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合,恰好反应生成NaY,测得混合溶液的pH=9,说明溶液呈碱性,这说明NaY为强碱弱酸盐,则A、NaY为强碱弱酸盐,水解呈碱性,水解促进水的电离,所以混合溶液中由水电离出的c(OH-)=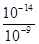 =mol/L=10-5mol/L,故A错误;B、溶液呈碱性,则有c(OH-)>c(H+),根据电荷守恒c(Na+)+c(H+)=c(Y-)+c(OH-),可得c(Na+)>c(Y-),溶液中离子浓度由大到小的顺序为 c(Na+)>c(Y-)>c(OH-)>c(H+),故B错误;C、根据物料守恒,应有c(HY)+c(Y-)=c(Na+),根据电荷守恒应有c(Na+)+c(H+)=c(Y-)+c(OH-),二者联式可得:c(HY)+c(H+)=c(OH-),则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1,故C正确;D、0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,从物料守恒的角度分析,溶液中应存在c(Na+)=c(Y-)+c(HY)=0.15mol•L-1,故D错误,答案选C。
=mol/L=10-5mol/L,故A错误;B、溶液呈碱性,则有c(OH-)>c(H+),根据电荷守恒c(Na+)+c(H+)=c(Y-)+c(OH-),可得c(Na+)>c(Y-),溶液中离子浓度由大到小的顺序为 c(Na+)>c(Y-)>c(OH-)>c(H+),故B错误;C、根据物料守恒,应有c(HY)+c(Y-)=c(Na+),根据电荷守恒应有c(Na+)+c(H+)=c(Y-)+c(OH-),二者联式可得:c(HY)+c(H+)=c(OH-),则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1,故C正确;D、0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,从物料守恒的角度分析,溶液中应存在c(Na+)=c(Y-)+c(HY)=0.15mol•L-1,故D错误,答案选C。
考点:考查酸碱中和滴定溶液酸碱性的判断;溶液pH计算以及溶液中离子浓度大小比较等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2012?成都模拟)溶液中的化学反应大多是离子反应.根据要求回答下列问题.
(2012?成都模拟)溶液中的化学反应大多是离子反应.根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
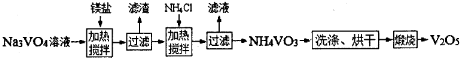
查看答案和解析>>
科目:高中化学 来源: 题型:
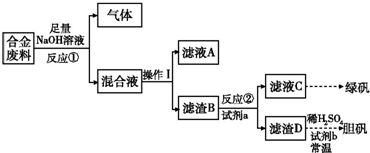
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:
www.ks5u.co m
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
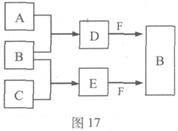
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热![]() ,氢气的燃烧热
,氢气的燃烧热![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com