
����Ŀ����1��ʵ�����ö������̸�Ũ���Ṳ�ȷ�Ӧ��ȡ��������ѧ����ʽ�� 4HCl��Ũ����MnO2![]() Cl2����MnCl2��2H2O��HCl ����������У�_____________________��
Cl2����MnCl2��2H2O��HCl �����������_____________________��
��2��KMnO4�dz��õ����������ø�����ظ�Ũ�������������������Ļ�ѧ����ʽ�ǣ�2 KMnO4 �� 16 HCl == 2KCl �� 2MnCl2 + 5Cl2�� + 8H2O ����˫���ŷ���ʾ�÷�Ӧ����ʽ�ĵ��ӵ�ʧ���_____________��
��3����ʷ���������ؿ���������������һ�������� CuCl2 ���������� 450�����ÿ����е��������Ȼ��ⷴӦ����������һ��Ӧ�Ļ�ѧ����ʽΪ_____________________��
��4����Ҫ�Ƶ� 71g �����������ַ����������� HCl ���ʵ���֮����_________�����뷴Ӧ�� HCl ����֮����_____________________��
��5���Ƚ�����������Ӧ��������������������ǿ������˳��Ϊ KMnO4>MnO2>O2������Ϊ�õ����˳��������ǣ�_____________________��
���𰸡� �ᡢ��ԭ��  4HCl + O2
4HCl + O2![]() 2H2O +2Cl2 1��1��1 10��8��5 ͬһ�ֻ�ԭ������ͬ��������������Ӧ����ӦԽ�����У���������������Խǿ
2H2O +2Cl2 1��1��1 10��8��5 ͬһ�ֻ�ԭ������ͬ��������������Ӧ����ӦԽ�����У���������������Խǿ
����������1����Ӧ����Ԫ�ػ��ϼ����ߣ�ͬʱ�����Ȼ������ɣ���HCl������������ᡢ��ԭ������������2��MnԪ�ػ��ϼ۴�+7�۽��͵�+2������Ԫ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ����ݵ��ӵ�ʧ�غ��֪��˫���ŷ���ʾ�÷�Ӧ����ʽ�ĵ��ӵ�ʧ���Ϊ ����3������ԭ���غ��֪��һ��Ӧ�Ļ�ѧ����ʽΪ4HCl + O2
����3������ԭ���غ��֪��һ��Ӧ�Ļ�ѧ����ʽΪ4HCl + O2![]() 2H2O +2Cl2����4����Ӧ�о��ǣ�1�۵���ԭ�ӱ�����Ϊ�����������Ҫ�Ƶ�71g������1mol�����ַ�����������HCl���ʵ���֮����1��1��1�����ݷ���ʽ��֪���뷴Ӧ��HCl����֮����4��16/5��2��10��8��5����5������ͬһ�ֻ�ԭ������ͬ��������������Ӧ����ӦԽ�����У���������������Խǿ�����Ը��ݷ���ʽ��֪������������������ǿ������˳��ΪKMnO4>MnO2>O2��
2H2O +2Cl2����4����Ӧ�о��ǣ�1�۵���ԭ�ӱ�����Ϊ�����������Ҫ�Ƶ�71g������1mol�����ַ�����������HCl���ʵ���֮����1��1��1�����ݷ���ʽ��֪���뷴Ӧ��HCl����֮����4��16/5��2��10��8��5����5������ͬһ�ֻ�ԭ������ͬ��������������Ӧ����ӦԽ�����У���������������Խǿ�����Ը��ݷ���ʽ��֪������������������ǿ������˳��ΪKMnO4>MnO2>O2��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������������Ʊ��������������й����ʵ�����������±���
������ | ��Է� | �ܶ� | �е�/�� | �ܽ�� |
������ | 74 | 0.80 | 118.0 | 9 |
������ | 60 | 1.045 | 118.1 | ���� |
���������� | 116 | 0.882 | 126.1 | 0.7 |
�������£�
����50mLԲ����ƿ�У�����18.5mL��������13.4mL�����ᣬ3��4��Ũ���ᣬͶ���ʯ����װ��ˮ�������ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ�������������ܣ�
�ڽ���ˮ���ֳ�������ͷ�ӦҺһ�����Һ©���У�ˮϴ��10% Na2CO3ϴ�ӣ���ˮϴ�����ת������ƿ�����
�۽�����������������������ƿ�У���ѹ�����ռ���֣���15.1g������������
��ش��й����⣺
��1����ˮӦ�ô����������a����b�����˹ܿ�ͨ�룮
��2�����з�Һ����ʱ��ʹ�õ�©��������ѡ���
��3������A��������������Ʊ������������Ļ�ѧ����Ϊ ��
��4������١����Ϸ����ȥ��Ӧ���ɵ�ˮ����Ŀ���� ��
��5�����������10% Na2CO3��Һϴ���л��㣬�ò�������Ŀ����
��6�������������IJ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CO2 ͨ�����Ϊ 50mL �� NaOH ��Һ�У�Ϊ�˲ⶨӦ����Һ�ijɷ֣������еμ� 1.0mol/L �����ᣬ������������������ CO2���������״���£��Ĺ�ϵ��ͼ��ʾ��

��1��OA �η�����Ӧ�����ӷ���ʽΪ��_______________________________��
��2����Һ�������ǣ�_____________�������ʵ���֮��Ϊ______________��
��3��ԭ NaOH ��Һ�����ʵ���Ũ��Ϊ_____________��
��4��ԭ NaOH ��Һ��ͨ�� CO2 �������_________mL��
��5������ NaOH ��Һ��ͨ������ CO2ʱ����Һ�е������� NaOH �� Na2CO3���������ʵ��֤�������ʵ���ɣ��벹��������
ʵ�鷽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У��������� BaCl2��Һ | ___________ | ˵����Һ�к��� Na2CO3 |
___________ | ___________ | ˵����Һ�к��� NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ֹ�̬�����ۻ�����������ʱ���˷������������������ͬ�����͵��ǣ� ��
A.����Ȼ���
B.���ʯ���ؾ�ʯ
C.��������ɱ�
D.��֬��������ͱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ����������백������ص�ʵ�飨ͼ�мг�װ�þ�����ȥ����
��1��д��ʵ������ȡ�����Ļ�ѧ����ʽ________________��
��2��Ҫ�õ�����İ�����ѡ��__________�������������ţ�
A����ˮ CaCl2 B��Ũ���� C��P2O5 D����ʯ��
��3����֪�����������л��ܼ� CCl4������װ���п����� NH3��β������װ�õ���______��
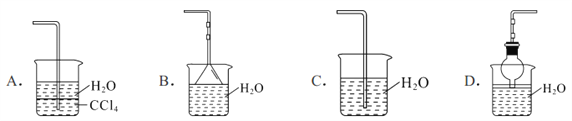
��4�����ֻ�ṩ��ͼ��װ�ã���˵��������Ȫ�ķ���___________��
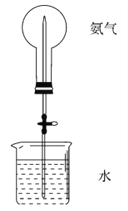
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
���е��ʲμӻ����ɵķ�Ӧһ����������ԭ��Ӧ
����Al2(SO4)3��Һ����εμ�Ba(OH)2��Һ�������ɰ�ɫ�������������ʧ
������BaCl2��NaOH�Ļ����Һ��ͨ�������Ķ����������壬�а�ɫ��������
����CaCl2��Һ��ͨ������������̼���壬�����ɰ�ɫ�������������ʧ
��101kPa��150��ʱ��agCO��H2�Ļ��������������O2����ȫȼ�գ���ȼ�պ�IJ���ͨ��������Na2O2�����Na2O2����ag
��Ϊ�ⶨ�����������Ƶĵ����ԣ����ڸ���(��Ҫ�ɷ���Al2O3) �������ۻ��������ƹ������в���
����������һ���ǽ���������
��22.4L��CO�����28gN2�����ĵ��������
A. �٢ڢܢޢ� B. �ۢܢ� C. �٢ݢޢ� D. �ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R���ӵ�����Ϊa g���������ΪM����M��a�ı�ֵ����
A.6.02��1023B.12Cԭ��������ʮ����֮һ
C.0.012kg12C������ԭ����D.1mol��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵���У���ȷ���ǣ� ��
A.��״���£�22.4 L����ķ�����ԼΪNA
B.�ܱ�������23 g NO2��N2O4�Ļ�������е�ԭ����Ϊ0.5NA
C.����������ˮ��Ӧʱ������0.1 mol����ת�Ƶĵ�����Ϊ0.4NA
D.1 L 0.1 molL��1��NaHCO3��Һ��HCO3����CO32��������֮��Ϊ0.1NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com