
设NA为阿伏加德罗常数的值.下列说法正确的是()
A. 1 mol甲苯含有C﹣H键数目为8NA
B. 1 mol丙烯酸中含有双键的数目为NA
C. 由a g C2H4和C3H6组成的混合物中所含共用电子对数目为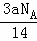
D. 在过氧化钠跟水的反应中,每生成2.24 L氧气,转移电子的数目为0.2NA
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.甲苯分子中含有8个H原子,则含有8个碳氢键,1mol甲苯中含有8mol碳氢键;
B.丙烯酸中含有1个碳碳双键和1个碳氧双键;
C.C2H4和C3H6的最简式为CH2,根据最简式计算出混合物中含有的C、H原子的物质的量,再根据有机物成键情况判断含有的共用电子对数目;
D.根据Na2O2与水的反应为歧化反应来分析.
解答: 解:A.1mol甲苯中含有8molH原子,则含有8mol碳氢键,含有8NA个C﹣H键,故A错误;
B.1mol丙烯酸中含有1mol碳碳双键、1mol碳氧双键,总共含有2mol双键,含有双键的数目为2NA,故B错误;
C.C2H4和C3H6中,每个C原子平均形成了1对碳碳共用电子对、每个H原子平均形成了1对碳氢共用电子对,a g的C2H4和C3H6的混合物中含有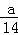 molCH2,故含有
molCH2,故含有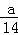 molC、
molC、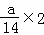 =
= molH原子,含有的共用电子对为
molH原子,含有的共用电子对为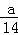 mol+
mol+ mol=
mol=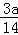 mol,故含有的共用电子对数为
mol,故含有的共用电子对数为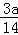 NA,故C正确;
NA,故C正确;
D.2.24 L氧气的物质的量为: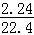 =0.1mol,Na2O2与水的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑,此反应中转移2mol电子,生成1mol氧气,故每生成0.1mol氧气,转移电子的数目为0.2NA,故D正确;
=0.1mol,Na2O2与水的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑,此反应中转移2mol电子,生成1mol氧气,故每生成0.1mol氧气,转移电子的数目为0.2NA,故D正确;
故选CD.
点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等.注意Na2O2与水的反应为歧化反应,丙烯酸分子中中含有2个双键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
可逆反应N2+3H2⇌2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示.下列各关系中能说明反应已达到平衡状态的是()
A. 3v正(N2 )=v正(H2 ) B. v正(N2 )=v逆(NH3)
C. 2v正(H2 )=3v逆(NH3) D. v正(N2 )=3v逆(H2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10mol•L﹣1 NaHCO3溶液的说法正确的是()
A. 溶质的电离方程式为NaHCO3═Na++H++CO32﹣
B. 25℃时,加水稀释后,n(H+)与n(OH﹣)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
D. 温度升高,c(HCO3﹣)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
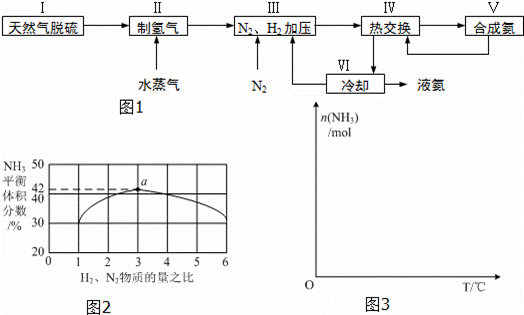
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生.NH4HS的电子式是 ,写出再生反应的化学方程式: .NH3的沸点高于H2S,是因为NH3分子之间存在着一种比 更强的作用力.
(2)室温下,0.1mol/L的氯化铵溶液和0.1mol/L的硫酸氢铵溶液,酸性更强的是 .已知:H2SO4:Ki2=1.2×10﹣2NH3•H2O:Ki=1.8×10﹣5.
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: (答案用小数表示,保留3位有效数字).
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) .简述本流程中提高合成氨原料总转化率的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
|
| A. | H2O(g)=H2(g)+ |
|
| B. | 2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 |
|
| C. | H2(g)+ |
|
| D. | 2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于“摩尔”的理解正确的是( )
-A.-摩尔是国际科学界建议采用的一种物理量
-B.-摩尔是物质的量的单位,简称摩,符号为mol
-C.-摩尔可以把物质的宏观数量与微观粒子的数量联系起来
-D.-国际上规定,0.012kg碳原子所含有的碳原子数目为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为( )
|
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com