
| A. | 前者多 | B. | 相等 | C. | 后者多 | D. | 无法判断 |
分析 NaF溶液中发生水解反应:F-+H2O?HF+OH-,溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaF溶液中c(Na+)+c(H+);然后结合电荷守恒判断溶液中离子总数大小.
解答 解:HF是弱酸,NaF溶液中发生水解反应:F-+H2O?HF+OH-,溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaF溶液中c(Na+)+c(H+),
根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V,
同理可得NaF溶液中总数为2×[c(Na+)+c(H+)]×V,
所以NaCl溶液中离子总数大于NaF溶液,
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒等知识为解答关键,要求学生能够根据盐的水解原理、电荷守恒、物料守恒判断溶液中各离子浓度大小.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 在Na2C2O4稀溶液中,c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
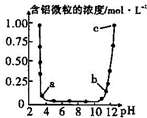 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )| A. | a点表示溶液中的Al3+开始转化为Al(OH)3沉淀 | |
| B. | 据图可知,配制一定物质的量浓度的AlCl3溶液时,需要加入适量的H2SO4溶液抑制水解 | |
| C. | 当溶液的pH在6至8之间,铝元素全部以Al(OH)3的形式存在 | |
| D. | b点所对应的溶液中主要含铝微粒的水解程度大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 热的纯碱溶液去油污效果 更好 | 温度升高,增大了油脂在碳 酸钠溶液中的溶解度 |
| B | 生活中的铝制品经久耐用 | 常温时铝不与氧气反应 |
| C | 氢氧化铁胶体通直流电,阴极颜色变深 | 氛氧化铁胶体带正电荷,在电场力的作用下,胶体向阴极迁移 |
| D | 二氧化破用作通讯光缆 | 二氧化硅对光信号有良好的 传输性能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 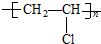 | B. | 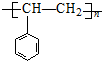 | ||
| C. | 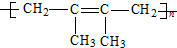 | D. | 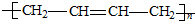 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com