
 (1)a图中的图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是3.2mL.
(1)a图中的图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是3.2mL.| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
分析 (1)量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为4,则刻度B为3,AB间每一小格为0.2mL,据此作答;
(2)滴定管刻度0刻度在上,从上到下增大,且最大刻度以下没有刻度,据此作答;
(3)排去碱式滴定管中气泡的方法:碱式滴定管应将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出,以排除气泡;
(4)
(1)①滴定管中未用标准液润洗,直接加入标准液会稀释溶液浓度减小;
②锥形瓶内水对滴定结果无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液的颜色变化,以判定滴定终点;
④如溶液颜色发生变化,且半分钟内不褪色为滴定终点;
(2)依据滴定前后消耗氢氧化钠溶液的体积的平均值,结合酸、碱反应定量关系计算得到.
解答 解:(1)量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为4,则刻度B为3,AB间每一小格为0.2mL,则量筒中液体的体积为3.2mL.
故答案为:3.2.
(2)滴定管刻度0刻度在上,从上到下增大,图Ⅱ表示50mL滴定管中液面的位置.如果液面处的 读数是a,且最大刻度以下没有刻度,则滴定管中液体的体积一定大于(50-a) mL.
故选D.
(3)碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出.
故答案为:丙.
(4)
(1)①滴定管中未用标准液润洗,直接加入标准液会稀释溶液浓度减小,消耗标准液体积增大,氢离子物质的量增大,4NH4++6HCHO═4H++(CH2)6N4+6H2O,反应可知测定氮元素含量偏高.故答案为:偏高.
②锥形瓶内水对滴定结果无影响.故答案为:无影响.
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液的颜色变化.
故选B.
④氢氧化钠滴定酸溶液,达到终点时,酚酞颜色变化为无色变化为红色,半分钟内不褪色.
故答案为:无,红.
(2)样品1.5000g,反应为4NH4++6HCHO═4H++(CH2)6N4+6H2O,消耗氢离子的物质的量和氮元素物质的量相同,依据图表数据分析可知,三次实验中消耗氢氧化钠溶液体积分别为:20.01mL,19.99mL,20.00mL,三次均有效,氢氧化钠溶液的平均体积为$V=\frac{20.01mL+19.99mL+20.00mL}{3}$=20.00mL;由酸碱中和反应可知,氢离子物质的量=氢氧化钠物质的量=0.1010mol/L×20.00mL×10-3=2.020×10-3mol,250ml溶液中氮元素物质的量和氢离子物质的量相同,该样品中氮的质量分数=$\frac{2.020×1{0}^{-3}mol×14g/mol×\frac{250}{25}}{1.500g}×100%$=18.85%.
故答案为:18.85%.
点评 本题考查了物质性质的实验探究实验设计和分析判断,中和滴定实验的步骤和操作方法,中和滴定计算应用,滴定管及量筒的读数问题,以及排气泡的实验操作.题目难度中等,是中档题.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2,b=1 | B. | a=3,b=2 | C. | a=2,b=2 | D. | a=3,b=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物A | 有机物B | 有机物C | 有机物D |
| ①可用于果实催熟 ②比例模型为  | ①由C、H两种元素组成 ②球棍模型为  | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同 ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
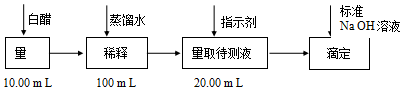
| 实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
| A | B | 消耗体积(mL) | ||
| 1 | 20.00 | 22.05 | ||
| 2 | 20.00 | 21.34 | ||
| 3 | 20.00 | 21.30 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| B. |  图表示用0.1000 mol•LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol•Lˉ1 | |
| C. |  图表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. |  图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 碱性锌锰电池比普通锌锰电池性能好 | 锌在碱性介质中被氧化成更高价态 |
| B | 施肥时,草木灰(有效成分为K2CO3)不能与铵盐氮肥混合使用 | 它们反应生成氨气会降低肥效 |
| C | 配制FeCl2溶液时加入少量铁粉 | 抑制Fe2+的水解 |
| D | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | 水和干木头的某些成分发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| B | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物中含有烯烃 |
| C | 向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体 | 不能证明氯元素的非金属性强于碳元素 |
| D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀 | 蔗糖未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com