
分析 (1)①标准状况下,2.24L即0.1molH2S气体通入100mL某浓度NaOH中,最后结晶获得固体质量为6.7g,
H2S+NaOH=NaHS+H2O
H2S+2NaOH=Na2S+2H2O
NaHS和Na2S的平均摩尔质量为$\frac{6.7g}{0.1mol}$=67g/mol,再求出二者的物质的量之比,求出物质的量,根据Na元素守恒计算;
②Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S;
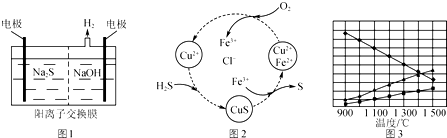
(2)①根据图中各元素化合价变化分析;
②该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,硫离子完全被氧化为S单质;
(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,再结合反应条件书写方程式.
解答 解:(1)①标准状况下,2.24L即0.1molH2S气体通入100mL某浓度NaOH中,最后结晶获得固体质量为6.7g,
H2S+NaOH=NaHS+H2O
H2S+2NaOH=Na2S+2H2O
得到到混合物的摩尔质量$\frac{6.7g}{0.1mol}$=67g/mol,
则NaHS与Na2S物质的量比为$\frac{78-67}{67-56}$=$\frac{1}{1}$,即均为0.05mol,
NaHS对应的氢氧化钠为0.05mol,Na2S对应的氢氧化钠为0.1mol
则原NaOH溶液的物质的量的浓度为$\frac{0.15mol}{0.1L}$=1.5mol/L,
故答案为:1.5mol/;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,
故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,
故答案为:Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=$\frac{1mol}{2}$=0.5mol,故答案为:0.5mol;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例,
故答案为:提高混合气体中空气的比例;
(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S$\stackrel{高温}{?}$2H2+S2,
故答案为:2H2S$\stackrel{高温}{?}$2H2+S2.
点评 本题以S为载体考查了可逆反应、氧化还原反应、电解原理等知识点,会正确分析图象中各个物理量的含义是解本题关键,再结合电解原理、氧化还原反应中各个物理量之间的关系、化学平衡有关知识来分析解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯酚显弱酸性,它能与氢氧化钠溶液反应 | |
| B. | 在苯酚钠溶液中通入二氧化碳气体,可得到苯酚 | |
| C. | 除去苯中混有的少量苯酚,可用溴水作试剂 | |
| D. | 苯酚有毒,但药皂中掺有少量苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列各物质均为中学化学中常见物质,其中A、B、C是三种常见金属.E在常温下是无色液体,D是空气的主要成分之一,与I反应生成E.K的焰色反应为黄色,J是一种磁性氧化物.在适当的条件下,它们之间可以发生如下图所示的转化(部分产物被略去).
下列各物质均为中学化学中常见物质,其中A、B、C是三种常见金属.E在常温下是无色液体,D是空气的主要成分之一,与I反应生成E.K的焰色反应为黄色,J是一种磁性氧化物.在适当的条件下,它们之间可以发生如下图所示的转化(部分产物被略去). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- | |
| C. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- | |
| D. | FeCl2溶液中:H2O2、Mg2+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,化学性质相似的一类有机物 | |
| B. | 分子量相差14或14整倍数的有机物 | |
| C. | 分子组成相差1个或者若干个CH2原子团的有机物 | |
| D. | 结构相似,分子组成相差1个或若干个CH2原子团的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 能量最低原则 | C. | 泡利不相容原理 | D. | 洪特规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com