
有关溶液中所含离子的检验,下列判断中正确的是( )
A.加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO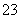 存在
存在
C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素
D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐酸盐溶液,只用NaOH溶液是不能一次鉴别开的
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )。
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案合理的是( )。
A.用通入酸性高锰酸钾溶液的方法除去乙烯中混有的二氧化硫
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.用灼热的铜丝网除去N2中混有的少量O2
D.用燃烧的方法除去CO2中混有的少量CO
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学想利用图示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
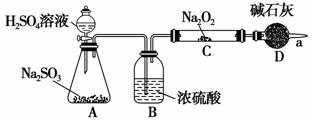
测得反应前C管的质量为m1 g,反应后C管的质量为m2 g,反应后装置D质量增加了n g。请分析:
Ⅰ.装置B的作用_________________________________________________;
装置D的作用_________________________________________________。
Ⅱ.如何检验反应中是否有O2生成______________________________________。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3,假设2:只有Na2SO4
假设3: ______________________________________________。
(1)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:将C中的固体配成溶液,加Ba(NO3)2溶液,得到白色沉淀,加足量稀硝酸,沉淀不溶解。得出结论:产物是Na2SO4。
该方案是否合理________(填“是”或“否”),理由是__________________________________________________________________
________________________________________________________________________。
(2)若假设1成立,某同学以反应前后C管的质量差(m2-m1)g为依据推断生成Na2SO3的质量为(m2-m1)×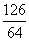 g。老师提示推算不合理,请你分析其中的缘由,________。
g。老师提示推算不合理,请你分析其中的缘由,________。
(3)若假设2成立,则参加反应的Na2O2的物质的量为________mol(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含的杂质。选用的试剂正确的是 ( )。
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | NaOH溶液 |
| B | CO2(SO2) | Na2CO3溶液 |
| C | FeCl2溶液(FeCl3) | Fe粉 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量
B.核磁共振氢谱中,CH3COOH、CH3OH都可给出两种信号
C.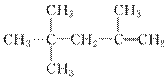 的名称为2,2,4三甲基4戊烯
的名称为2,2,4三甲基4戊烯
D.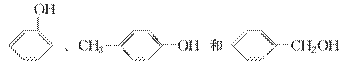 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平_________________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO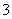 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式___________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式___________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O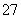 ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式___________。
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式___________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com