
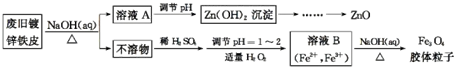
分析 根据实验流程图可知:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用;
(2)持续通入N2,防止Fe2+被氧化;
(3)Fe3O4胶体粒子能透过滤纸;
(4)根据m=cVM计算m(K2Cr2O7);根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,用250mL容量瓶用于配置溶液,胶头滴管用于加水定容;
(5)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$对V(标准)的影响来判断.
解答 解:(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,
故答案为:AB;
(2)Fe2+容易被氧化,持续通入N2,防止Fe2+被氧化;
故答案为:在N2气氛下,防止Fe2+被氧化;
(3)Fe3O4胶体粒子能透过滤纸,所以不能用过滤的方法实现固液分离,
故答案为:不能;
(4)m(K2Cr2O7)=0.01000mol•L-1×0.250 L×294.0 g•mol-1=0.7350g;
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,用玻璃棒搅拌,恢复室温,用玻璃棒引流,移入250mL容量瓶中,继续加水至离刻度线1-2cm处,改用胶头滴管加水定容,故用不到的仪器为量筒和移液管,
故答案为:0.7350;③⑦;
(5)滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,造成消耗的V(标准)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,则测定结果偏大;
故答案为:偏大.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制及滴定的误差分析、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
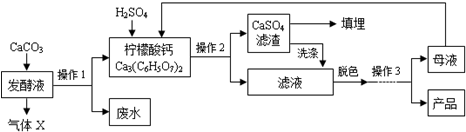
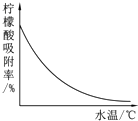 柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
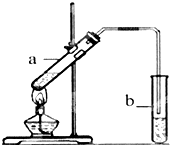 葡萄可用于酿酒.
葡萄可用于酿酒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
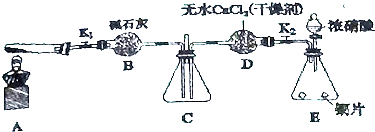
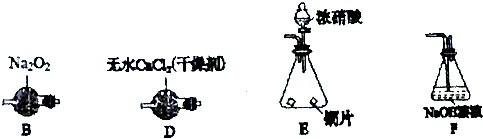
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
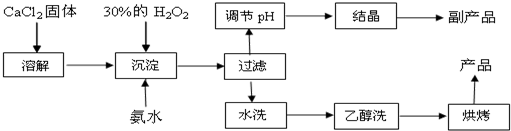
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
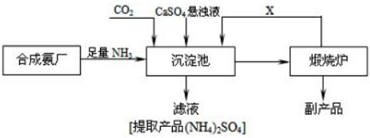
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
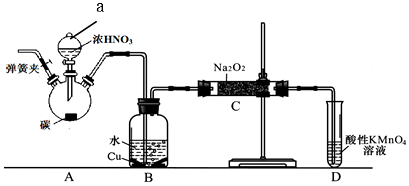
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com