
【题目】化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
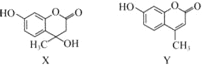
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
科目:高中化学 来源: 题型:
【题目】现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如图):

据此完成下列回答:
(1)写出各物质的化学式:
甲:______________乙:_______________丁:________________;
(2)写出下列反应的离子方程式:
甲+乙:________________________________,
沉淀a+溶液b:________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应。又知E溶液是无色的。请回答:

(1)写出E物质的化学式_______________。
(2)写出G→H的化学方程式_____________________________________________。
(3)写出B+F→D的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)![]() 2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
A. 增大压强,平衡常数将增大
B. 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n mol Cl2
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,回答:
(1)如果粗盐中含SO42-含量较高必须添加钡试剂除去SO42-,该钡试剂可以是___________
A. Ba(OH)2 B. Ba(NO3)2 C.BaCl2
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序是________
A.NaOH、Na2CO3、钡试剂 B.NaOH、钡试剂、Na2CO3 C.钡试剂、NaOH、Na2CO3
(3)电解过程中,________极生成Cl2,写出检验该产物的方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮广泛分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g)![]() Si3N4(s) + 6CO(g) ΔH=-1591.2 kJ/mol则该反应每转移1mol e-,可放出的热量为________
Si3N4(s) + 6CO(g) ΔH=-1591.2 kJ/mol则该反应每转移1mol e-,可放出的热量为________
(2)高温时,用CO还原MgSO4可制备高纯MgO
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是:____________
②由MgO制成的Mg可构成“镁—次氯酸盐”电池,其装置示意图如图,该电池的正极反应式为____________

(3)某研究小组将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),得到如下数据:
CO2(g) + H2(g),得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
2 | 900 | 1 | 2 | 0.5 | 0.5 | — |
①实验Ⅰ中,前5min的反应速率v(CO2)=___________
②下列能判断实验Ⅱ已经达到平衡状态的是(填写选项序号)__________
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示,b点v正_______v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是______________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素单质及其化合物有着广泛应用。
(1)在1. 0 L密闭容器中放入0. 10mol PCl5(g),一定温度进行如下反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
时间t/s 温度 | 0 | t1 | t2 | t3 | t4 | t5 |
T1 | 5. 00 | 7. 31 | 8. 00 | 8. 50 | 9. 00 | 9. 00 |
T2 | 6. 00 | -- | -- | -- | 11. 00 | 11. 00 |
回答下列问题:
①PCl3的电子式为_______。
②T1温度下,反应平衡常数K=______。
③T1___T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __α2(T2)。
(2)NO在一定条件下发生如下分解:3NO(g)![]() N2O(g)+NO2(g)
N2O(g)+NO2(g)
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是________(填字母序号)。
a. n(N2O)=n(NO2) b. 容器内压强保持不变 c. v正(N2O)=v逆(NO2) d. 气体颜色保持不变
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。

①Co的电极反应式为_______。
②A、B、C为离子交换膜,其中B为____离子交换膜(填“阳”或“阴”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com