
| A. |  表示0.001 mol•L一1盐酸滴定0.001 mol•L一1NaOH溶液的滴定曲线 | |
| B. | 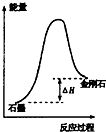 所示,石墨的熔点比金刚石低 | |
| C. | 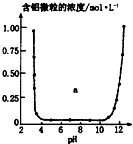 表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 | |
| D. | 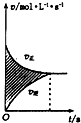 所示,图中的阴影部分面积的含义是[v(正)-v(逆))] |
分析 A、盐酸滴定氢氧化钠,反应终点的pH应为7;
B、物质的熔点与物质的能量高低没有必然的关系,还要看物质的结构;
C、Al3+中加入OH一反应先生成氢氧化铝溶液,溶液中铝微粒浓度减小,随着溶液碱性增强,氢氧化铝与碱反应生成偏铝根离子,溶液中铝微粒浓度增大,a区域的物质是Al(OH)3;
D、图中阴影部分的面积为[c(反应物)-c (生成物)].
解答 解:A、盐酸滴定氢氧化钠,反应终点的pH应为7,而图中为6,故A错误;
B、从图上可知,石墨能量比金刚石低,石墨稳定,但物质的熔点与物质的能量高低没有必然的关系,还要看物质的结构,故B错误;
C、Al3+中加入OH一反应先生成氢氧化铝溶液,溶液中铝微粒浓度减小,随着溶液碱性增强,氢氧化铝与碱反应生成偏铝根离子,溶液中铝微粒浓度增大,a区域的物质是Al(OH)3,故C正确;
D、图中阴影部分的面积为[c(反应物)-c (生成物)],故D错误;
故选C.
点评 本题考查了据图分析中和滴定中的pH变化、物质的能量越低越稳定、铝离子的存在、正逆反应速率变化图线及含义,题目难度较大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.60L | B. | 6.72L | C. | 4.48L | D. | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:
已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
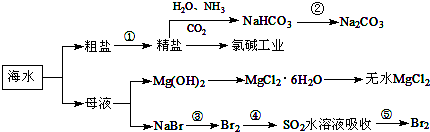
| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com