
【题目】某研究性学习小组为探究SO2的性质,设计如图所示实验装置(装置中的固定仪器和酒精灯均未画出):请回答下列问题:
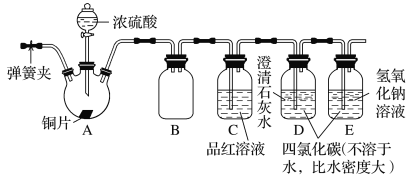
(1)B装置与D、E两装置中四氯化碳(CCl4)的作用相同,其作用是___。
(2)C装置中的现象是___,该现象证明SO2具有__性。
(3)若将C装置中的试剂换成酸性KMnO4溶液,发生反应的离子方程式为__,证明SO2具有__性。
(4)若将C装置中的试剂换成Na2S溶液,则现象为__,证明SO2具有___性。
【答案】防倒吸 (品红溶液)褪色 漂白 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 还原 有淡黄色沉淀生成 氧化
【解析】
铜和浓硫酸在加热条件下反应生成硫酸铜、二氧化硫、水;二氧化硫通入品红溶液,品红溶液褪色;二氧化硫是酸性氧化物,二氧化硫和氢氧化钙反应生成亚硫酸钙沉淀和水;最后用氢氧化钠溶液吸收二氧化硫。
(1)B装置中两侧导管刚露出橡胶塞,B具有防倒吸的作用,二氧化硫难溶于CCl4,能防倒吸,所以B和D、E装置中四氯化碳(CCl4)的作用相同,其作用是防倒吸;
(2)二氧化硫具有漂白性,能使品红溶液褪色,C装置中的现象是溶液褪色,该现象证明SO2具有漂白性。
(3)二氧化硫具有还原性,若将C装置中的试剂换成酸性KMnO4溶液,高锰酸钾把二氧化硫氧化为硫酸,发生反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,证明SO2具有还原性。
(4)若将C装置中的试剂换成Na2S溶液,发生反应3SO2+2Na2S=2Na2SO3+3S↓,则现象为有淡黄色沉淀生成,二氧化硫中S元素化合价降低,证明SO2具有氧化性。


科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是( )
A. PH3和AsH3的熔点
B. Br2在水中的溶解度和Br2在CCl4溶液中的溶解度
C. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
D. HClO和HClO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.050 mol·L-1,15℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如下表所示。回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
c/mol/L | 0.050 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
计算该反应在120~180s间的平均反应速率v(OH-)=_________;比较120~180s与180~240 s 区间的平均反应速率的大小,前者___________后者(填>,<或=),理由是:____________。
(2)某研究小组在实验室将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,温度恒定,固体试样体积忽略不计),t1时刻,反应:NH2COONH4(s)2NH3(g)+CO2(g)达到分解平衡。请在图中画出容器内NH3和CO2的物质的量浓度随时间变化的趋势图:_________
(3)工业上合成尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s) +H2O(g) 。在一定温度和压强下,往容积可变的密闭容器内通入物质的量各为1mol的氨气和二氧化碳发生上述反应。下列说法中能说明该反应一定达到化学平衡的是_______________。
A.断裂amol的N—H键的同时消耗a/2 mol的尿素
B.密闭容器中二氧化碳的体积分数保持不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中混合气体的平均摩尔质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
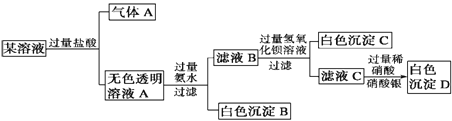
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是
溶液 | 现象 | 结论 |
| |
A | 品红溶液 | 红色溶液褪色 | SO2有漂白性 | |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
D | 滴有酚酞的NaOH溶液 | 红色溶液褪色 | SO2的水溶液呈酸性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是

A.该过程将太阳能转化成为化学能
B.该过程中,涉及极性键和非极性健的断裂与生成
C.氧化剂与还原剂的物质的量之比为3∶1
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2. N2的电子式为____________,该反应的方程式为___________________________________________
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为_________________(已知该反应为置换反应)
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为______,K的原子结构示意图为_______________________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com