
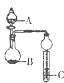
| A、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| B、若A为浓硫酸,B为木炭,C中盛有硅酸钠溶液,则C中出现白色浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀不溶解 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
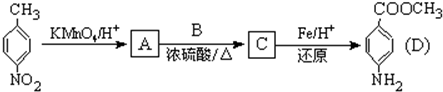
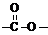 结构的基团的C的所有同分异构体的结构简式:
结构的基团的C的所有同分异构体的结构简式: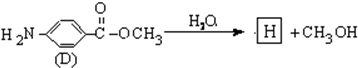
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
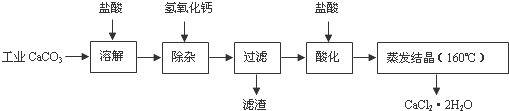
 牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:
牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
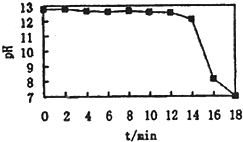
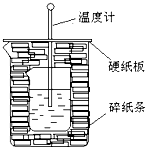 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
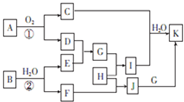 物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.
物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验中所用到的锥形瓶和容量瓶,在洗涤后均需要润洗 |
| B、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,最终氢氧化钠溶液浓度将偏大 |
| C、滴定时,左手提酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视滴定管内液面变化 |
| D、中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入煤矿井下作业,戴上安全帽,用帽上的矿灯照明 |
| B、节日期间,可以在热闹繁华的商场里燃放烟花爆竹,欢庆节日 |
| C、点燃打火机,可以检验液化气钢瓶口是否漏气 |
| D、实验室里,可以将水倒入浓硫酸及时用玻璃棒搅拌,配制稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com