
【题目】实验室制备Cl2通常采用如图所示装置:

(1)A装置中发生反应的化学方程式是________;每生成0.5 mol Cl2,被氧化的物质的物质的量是_____mol。
(2)仪器a的名称是_________;
(3)B装置中所盛的试剂是________________;
(4)实验时,通常采用密度为1.19 g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为________;
(5)将如图装置代替装置D和E,可进行“氯气与金属钠反应”的实验,以下叙述正确的是________。

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气
C. 玻璃管中,钠燃烧时会产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
(6)E装置中发生反应的化学方程式是________________;为验证E装置反应后的溶液中存在Cl-,正确的操作是_____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1 分液漏斗 饱和食盐水 11.9 mol/L ABD Cl2+2NaOH=NaCl+NaClO+H2O 取少量烧杯内吸收Cl2的溶液于试管中,加入足量的稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,证明其中还有Cl-
MnCl2+Cl2↑+2H2O 1 分液漏斗 饱和食盐水 11.9 mol/L ABD Cl2+2NaOH=NaCl+NaClO+H2O 取少量烧杯内吸收Cl2的溶液于试管中,加入足量的稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,证明其中还有Cl-
【解析】
浓盐酸与MnO2混合加热反应产生Cl2,制取的Cl2中含有杂质HCl、H2O蒸气,先通过饱和NaCl溶液除去HCl,再通过浓硫酸干燥Cl2,然后在装置D中收集。由于Cl2是大气污染物,在排放前要进行尾气处理,可根据其与碱反应的性质,用NaOH溶液进行尾气处理,据此解答。
(1)在A装置中浓盐酸与MnO2混合加热反应产生Cl2,反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;根据方程式可知:每反应产生1 mol Cl2,转移2 mol电子,氧化2 mol HCl,则反应生成0.5 mol Cl2,被氧化的HCl的物质的量是1 mol;
MnCl2+Cl2↑+2H2O;根据方程式可知:每反应产生1 mol Cl2,转移2 mol电子,氧化2 mol HCl,则反应生成0.5 mol Cl2,被氧化的HCl的物质的量是1 mol;
(2)根据装置图可知仪器a的名称是分液漏斗;
(3)B装置中所盛的试剂是饱和食盐水,作用是除去Cl2中的杂质HCl;
(4)密度为1.19 g/cm3、浓度为36.5%的浓盐酸的物质的量浓度c=![]() mol/L=11.9 mol/L;
mol/L=11.9 mol/L;
(5)Cl2与Na反应方程式为:2Na +Cl2![]() 2NaCl。
2NaCl。
A. 该反应产生NaCl白色固体,因此会看到有白烟现象,A正确;
B. 由于NaOH溶液能够与Cl2发生反应,所以玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气,B正确;
C. 玻璃管中,钠燃烧时会产生黄色火焰,C错误;
D. 若Cl2未被NaOH溶液完全吸收,逸出的氯气会与KI发生反应:2KI+Cl2=2KCl+I2,产生的I2遇淀粉溶液变为蓝色,若完全被吸收,就不会出现蓝色,所以在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收,D正确;
故合理选项是ABD;
(6)在E装置中,Cl2与NaOH溶液发生反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;为验证E装置反应后的溶液中存在Cl-,正确的操作是取少量烧杯内吸收Cl2的溶液于试管中,先向溶液中加入HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,就证明溶液中含Cl-,反应的离子方程式为Ag++Cl-=AgCl↓。


科目:高中化学 来源: 题型:
【题目】硬脂酸甘油酯在碱性条件下水解的装置如图所示。
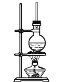
进行皂化反应实验的操作步骤如下:
(1)在圆底烧瓶中加入7~8g硬脂酸甘油酯,然后加入2~3gNaOH、5mL水和10mL酒精,其中加入酒精的作用是___。
(2)加热反应混合物约10min,皂化反应基本完成,所得的混合物为___(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入食盐细粒,静置一段时间,溶液分为上下两层,高级脂肪酸钠盐在___层,这个过程称为___。
(4)装置中长玻璃导管的作用为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,反应方程式表示为2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O。下列对该反应的叙述中错误的是( )
N2↑+Cl2↑+2O2↑+4H2O。下列对该反应的叙述中错误的是( )
A.瞬间产生大量高温气体推动航天飞机飞行
B.从能量变化的角度,主要是化学能转变为热能和动能
C.反应的焓变小于零
D.在方程式后增加ΔH及其数值即为热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成:

![]() 是一种气态烃,写出A的结构简式 ______ ;
是一种气态烃,写出A的结构简式 ______ ;
![]() 的反应类型是 ______ ;
的反应类型是 ______ ;
![]() 写出
写出![]() 的化学方程式 ______ ;
的化学方程式 ______ ;
![]() 下列关于G的说法正确的是 ______
下列关于G的说法正确的是 ______
![]() 能与溴单质反应
能与溴单质反应
![]() 能发生水解反应
能发生水解反应
![]() G最多能和5mol氢气反应
G最多能和5mol氢气反应
![]() 分子式是
分子式是![]()
![]() 写出满足以下条件的B的同系物所有同分异构体的结构简式 ______
写出满足以下条件的B的同系物所有同分异构体的结构简式 ______
![]() 分子式为
分子式为![]() 能发生银镜反应
能发生银镜反应![]() 能发生水解。
能发生水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C互为同分异构体,分子式均为![]() ,有关的转化关系如下图所示。
,有关的转化关系如下图所示。

已知:![]() 的碳链无支链,且
的碳链无支链,且![]() A能与足量
A能与足量![]() 完全反应可得到
完全反应可得到![]() 单质Ag;
单质Ag;
![]() 为含有一个五环的酯;
为含有一个五环的酯;
![]() CH3—CH=CH—R
CH3—CH=CH—R![]() Br—CH2—CH=CH—R
Br—CH2—CH=CH—R
请回答下列问题:
![]() 中所含官能团的名称是 ______ 。
中所含官能团的名称是 ______ 。
![]() 、H的结构简式依次为 ______ 、 ______ 。
、H的结构简式依次为 ______ 、 ______ 。
![]() 的加聚反应产物的结构简式为 ______ 。
的加聚反应产物的结构简式为 ______ 。
![]() 不能发生反应的反应类型有 ______
不能发生反应的反应类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 取代反应
取代反应![]() 加成反应
加成反应![]() 银镜反应
银镜反应![]() 水解反应
水解反应![]() 消去反应
消去反应 ![]() 聚合反应
聚合反应![]() 氧化反应
氧化反应![]() 还原反应
还原反应![]() 皂化反应
皂化反应![]() 酯化反应
酯化反应
![]() 写出
写出![]() 的反应方程式: ______
的反应方程式: ______ ![]() 只写
只写![]() 条件下的反应,有机物用结构简式表示
条件下的反应,有机物用结构简式表示![]() 。
。
![]() 是D的同分异构体,且符合以下条件:
是D的同分异构体,且符合以下条件:
![]() 分子中只含有一个甲基
分子中只含有一个甲基![]() ;
;
![]() 能发生银镜反应;
能发生银镜反应;
![]() M与足量Na反应能产生标准状况下
M与足量Na反应能产生标准状况下![]() 的气体;
的气体;
![]() 除官能团上的氢原子外,还有两种不同类型的氢原子。
除官能团上的氢原子外,还有两种不同类型的氢原子。
请任意写出一种符合条件的M的结构简式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1的NaOH溶液与25.00 mL 0.1000 mol·L-1HA(-元酸)溶液进行滴定实验,得到滴定曲线(如图所示),下列说法不正确的是

A.HA为-元弱酸
B.常温下,HA的电离平衡常数Ka=10-5
C.M点时溶液的pH=7,此时加入的V(NaOH)<25.00 mL
D.可选用甲基橙作指示剂,到达滴定终点时溶液由红色变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在A处通入未经干燥的氯气。当关闭B阀时C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是( )
①饱和NaCl溶液②NaOH溶液③H2O④浓硫酸

A.①B.①③C.②④D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com