
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
【答案】D
【解析】设合金中Cu、Mg的物质的量分别为x、y,根据题目所给信息知64x+24y=1.52①;在反应过程中有:Cu-2e-=Cu2+、Mg-2e-=Mg2+,Cu2++2OH-=Cu(OH)2↓、Mg2++2OH-=Mg(OH)2↓,所以金属失去电子的物质的量等于金属阳离子完全沉淀所需OH-的物质的量,n(OH-)=![]() =0.06mol,故2x+2y=0.06②,由①和②组成方程组解得x=0.02 mol,y=0.01 mol。A项,由上述计算可得,铜与镁的物质的量之比是2∶1,A正确;B项,根据c=
=0.06mol,故2x+2y=0.06②,由①和②组成方程组解得x=0.02 mol,y=0.01 mol。A项,由上述计算可得,铜与镁的物质的量之比是2∶1,A正确;B项,根据c=![]() 可得:c(HNO3)=
可得:c(HNO3)= ![]() molL-1=14.0 mol·L-1,B正确;由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒,硝酸完全被还原为NO2,则NO2的物质的量应为0.06 mol,已知得到混合气体1 120 mL(标准状况),即0.05 mol混合气体,是因为存在2NO2
molL-1=14.0 mol·L-1,B正确;由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒,硝酸完全被还原为NO2,则NO2的物质的量应为0.06 mol,已知得到混合气体1 120 mL(标准状况),即0.05 mol混合气体,是因为存在2NO2![]() N2O4,可求得N2O4为0.01 mol,NO2为0.04 mol,故C正确;D项,得到2.54 g沉淀时,消耗0.06 mol NaOH(浓度为1.0 mol·L-1),体积为60 mL,故D错误。
N2O4,可求得N2O4为0.01 mol,NO2为0.04 mol,故C正确;D项,得到2.54 g沉淀时,消耗0.06 mol NaOH(浓度为1.0 mol·L-1),体积为60 mL,故D错误。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。

①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
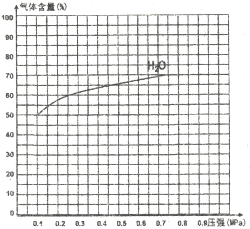
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色。实验流程如下:

请回答:
(1)步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
(3)烘干时,温度控制在80℃为宜,理由是 。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极。请写出阳极的电极反应式 ,与原方法相比,电解法的优势为 。
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①量取KMnO4溶液应选用 (填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将 (填“偏大”、“偏小”或“不变”)。
②滴定过程中反应的离子方程式为______。(已知:常温下0.01 mol/L的H2C2O4溶液的pH为2.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。请回答下列问题:

(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式___________________________。
(3)元素第一电离能为⑤____________⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有___________对弧对电子,其VSEPR模型为_________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:

(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ _____________ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,拟探究和比较SO2和C12的漂白性,设计如下图所示的实验装置二套。请你参与探究并回答下列问题。

(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液 (填“能”或“不能” )褪色,然后再加热试管,溶液 (填“恢复”或“不恢复”)红色;
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液 (填“恢复”或“不恢复”)红色;
(3)由以上两个实验可以说明SO2和C12的漂白原理 (填“相同”或“不相同”);
(4) C12通入品红溶液中,生成的具有漂白性的物质是 (填“HC1”或“HClO”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25摄氏度时,现有浓度均为0.10 mol/L的四种溶液:①氨水 ② NaOH溶液 ③CH3COOH溶液 ④盐酸。请回答:
(1)①溶液中c(H+) c(OH-) (填“>”、“<”或“=”)。
(2)醋酸的电离方程式是 。
(3)①对水的电离平衡产生的影响是 ,理由是 。
(4)溶液②和溶液③等体积混合后所得溶液显碱性,原因是 (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com