
����Ŀ���Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_________________________��
��2����˵����CO2Ϊԭ�Ϻϳ��Ҵ����ŵ���_____________________��ֻҪ��д��һ������
��3����һ��ѹǿ�£���ø÷�Ӧ��ʵ���������±���
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
�� �÷�Ӧ��___________��Ӧ������ȡ����ȡ�����
�� һ�����������������̼��[n(H2)/n(CO2)]����CO2��ת����______________�����������С�������䡱��
��4��һ���Ҵ�ȼ�ϵ���з����Ļ�ѧ��ӦΪ����������Һ���Ҵ�������������ˮ�Ͷ���
��̼���õ�صĸ�����ӦʽΪ��_______________________________________��
��5��25����101 kPa�£�H2(g)��C2H4(g)��C2H5OH(l)��ȼ���ȷֱ���285.8 kJ �� mol��1��1411.0 kJ �� mol��1��1366.8 kJ �� mol��1����д����C2H4(g)��H2O(l)��Ӧ����C2H5OH(l)���Ȼ�ѧ����ʽ____________________________________________________��
���𰸡� c(CH3CH2OH)c3(H2O)/c2(CO2)c6(H2) �����������ã������ڻ��� ���� ���� C2H5OH��12e-+3H2O=2CO2��+12H+ C2H4(g)+H2O(l)=C2H5OH(l) ��H=��44.2kJ/mol
��������(1)2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)�����ݷ�Ӧ��ѧ����ʽ����ϻ�ѧƽ�ⳣ���ĸ�����ʽд��ƽ�ⳣ������ʽΪ�� 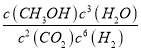 ���ʴ�Ϊ��
���ʴ�Ϊ�� 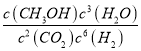 ��
��
(2)��CO2Ϊԭ�Ϻϳ��Ҵ������ٶ�����̼��ɵ�����ЧӦ�����������ã������ڻ������ʴ�Ϊ�����������ã������ڻ�����
(3)����ͼ�������жϣ����¶����ߣ�������̼ת���ʼ�С��˵��ƽ��������У����������ȷ�Ӧ���������Ƿ��ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��һ�������£��������̼��[n(H2)/n(CO2)]��ͼ�����ݷ�����ͬ�¶��£�������̼ת�������ʴ�Ϊ������
(4)���������£��Ҵ��ڸ�������������Ӧ���ɶ�����̼������ӦΪC2H5OH-12e-+3H2O=2CO2+12H+���ʴ�Ϊ��C2H5OH+3H2O-12e-�T2CO2+12H+��
(5)��֪H2(g)��C2H4(g)��C2H5OH(l)��ȼ���ȷֱ���-285.8kJ/mol��-1411.0kJ/mol��-1366.8kJ/mol�����У���H2(g)+ ![]() O2(g)=H2O(l)��H=-285.8kJ/mol����C2H4(g)+2O2(g)=2H2O(l)+2CO2(g)��H=-1411.0kJ/mol����C2H5OH(l)+2O2(g)=3H2O(l)+2CO2 (g)��H=-1366.8kJ/mol�����ݸ�˹���� ������-�ۿɵã�C2H4(g)+H2O(l)=C2H5OH(l) ��H=-44.2kJ/mol���ʴ�Ϊ��C2H4(g)+H2O(l)�TC2H5OH(l)����H=-44.2 kJ/mol-1��
O2(g)=H2O(l)��H=-285.8kJ/mol����C2H4(g)+2O2(g)=2H2O(l)+2CO2(g)��H=-1411.0kJ/mol����C2H5OH(l)+2O2(g)=3H2O(l)+2CO2 (g)��H=-1366.8kJ/mol�����ݸ�˹���� ������-�ۿɵã�C2H4(g)+H2O(l)=C2H5OH(l) ��H=-44.2kJ/mol���ʴ�Ϊ��C2H4(g)+H2O(l)�TC2H5OH(l)����H=-44.2 kJ/mol-1��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:2CO(g)+O2(g)=2CO2(g) ��H=-566kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ��H=-226kJ/mol�����������Ȼ�ѧ����ʽ�жϣ�����˵����ȷ����( )

A. CO��ȼ����Ϊ566kJ/mol
B. ��ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ��H>-452kJ/mol
D. CO2 (g)��Na2O2(s)��Ӧ�ų�452kJ����ʱ��ת�Ƶ��Ӹ���Ϊ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�ͦ�2�ֱ�ΪA��B����������������ƽ����ϵA(g)![]() 2B(g)��2A(g)
2B(g)��2A(g)![]() B(g)��ת���ʣ����¶Ȳ��������£�������A�����ʵ����������ж���ȷ����
B(g)��ת���ʣ����¶Ȳ��������£�������A�����ʵ����������ж���ȷ����
A. ��1����2����С B. ��1����2������
C. ��1��С����2���� D. ��1����2��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�Ϊͬ���칹�����
A.12C��14CB.����������
C.���ʯ��ʯīD.�Ҵ��Ͷ�����[CH3OCH3]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒ�������⣬�Ը�����Ʒ������ʩ��������
A. ��ʱ��ʹ�õ�����Ϳ���� B. ��������ˮ�ܲ���ͭ��
C. ͭ��ñ�ķ�����Ϳ������ D. ���г���Ȧ�Ƹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D����ѧ��������������ᴿ�Ļ���װ�á�����ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D�����ʵ��Ŀո��С�

(1)��ȥCa(OH)2��Һ��������CaCO3_________________��
(2)�ӵ�ˮ��ȡ��______________��
(3)������ˮ��ȡ����ˮ_________________��
(4)����ֲ���ͺ�ˮ_____________��
(5)�뺣ˮɹ��ԭ���������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺

(1)��Ũ������HCl�����ʵ���Ũ��Ϊ__________mol��L��1��
(2)ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����________(����ĸ)��
A����Һ��HCl�����ʵ���
B����Һ��Ũ��
C����Һ��Cl������Ŀ
D����Һ���ܶ�
(3)ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.400 mol��L��1��ϡ���ᡣ
�ٸ�ѧ����Ҫ��ȡ________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿(����������A��ʾ��ƫ��������B��ʾ��ƫС������C��ʾ����Ӱ����)��
a������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ����____��
b�����ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ��____��
(4)�ټ����ͬѧ�ɹ�������0.400 mol��L��1�����ᣬ�����ø������кͺ�0.4 g NaOH��NaOH��Һ�����ͬѧ��ȡ________mL���ᡣ
�ڼ����ͬѧ�������Ƶ������кͺ�0.4 g NaOH��NaOH��Һ�����ֱȢ����������ƫС������ܵ�ԭ����________��(����ĸ)
A��Ũ����ӷ���Ũ�Ȳ���
B��������Һʱ��δϴ���ձ�
C��������Һʱ����������ƿ�̶���
D����ˮʱ�����̶��ߣ��ý�ͷ�ι�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ����������Ķ��ε�����㷺Ӧ�����������綯��������
��1��Ǧ��������������PbO2�ĵ缫Ϊ_______������һ��������Pb�������Ϊ_______��
��2��Ǧ������ȫ�ŵ��������������Ҫ��������_______�����ʱǦ���صĸ������淢��_______ (����������������ԭ��)��Ӧ��
��3����ʯīΪ�缫���Pb(NO3)2��Cu(NO3)2�Ļ����Һ���Ƶ�PbO2�����ʱ���������ĵ缫��ӦʽΪ___________________�������۲쵽��������_______________�������Һ�в�����Cu(NO3)2�����������ĵ缫��ӦʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��0.5 mol CH4��������________���ڱ�״���µ����Ϊ________��
��2��3.1 g Na2X����Na�� 0.1 mol����Na2X��Ħ������Ϊ________��X�����ԭ������Ϊ________��
��3��0.6 mol��������0.4 mol����(O3)����֮��Ϊ________�����Ӹ���֮��Ϊ________����ԭ�Ӹ���֮��Ϊ________��
��4��8.5 g���������Ӻ��еĵ�����ĿΪ________��
��5��14 g C2H4��C4H8�Ļ�����������ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com