
【题目】某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

请回答下列问题。
(1)硬质试管中发生的化学方程式___________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管中固体物质一定有_________,可能有_________(填写“化学式”),若溶液未变红色,则说明硬质试管中固体物质的成分是___________________(填写“化学式”)。

(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:______(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述白色沉淀变成红褐色的反应的化学方程式____________________________。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有_____性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是_________,并且配制含Fe2+的盐溶液时应加入少量_____________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 Fe3O4 Fe Fe3O4和Fe Fe+2Fe3+=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 还原 Fe2+易被空气中的氧气氧化而变质 铁粉或铁屑
Fe3O4+4H2 Fe3O4 Fe Fe3O4和Fe Fe+2Fe3+=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 还原 Fe2+易被空气中的氧气氧化而变质 铁粉或铁屑
【解析】
(1)铁粉与水蒸气反应,生成Fe3O4和H2;
(2)KSCN遇到Fe3+后迅速出现血红色,利用该方法检验Fe3+;
(3)铁粉能将Fe3+还原为Fe2+;
(4)滴入NaOH溶液后,Fe(OH)2白色沉淀逐渐变为灰绿色,最终变为红褐色的Fe(OH)3;
(5)铁粉能将Fe3+还原为Fe2+,Fe2+具有还原性,Fe2+易被空气中的O2氧化。
(1)铁粉与水蒸气反应,生成Fe3O4和H2,反应方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)取少量溶液B滴加KSCN溶液,若溶液变红色,说明硬质试管中固体物质一定有Fe3O4,可能含有Fe,若溶液未变红色,说明硬质试管中固体物质的成分是Fe3O4和Fe;
(3)铁粉能将Fe3+还原为Fe2+,离子方程式为:Fe+2Fe3+=3Fe2+;
(4)试管中滴入NaOH溶液后,Fe(OH)2白色沉淀逐渐变为灰绿色,最终变为红褐色的Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)铁粉能将Fe3+还原为Fe2+,Fe2+具有还原性,Fe2+易被空气中的O2氧化,因此实验室中含Fe2+的盐溶液现用现配制,因此配制含Fe2+的盐溶液时应加入少量铁粉或者铁屑,防止Fe2+被氧化。


科目:高中化学 来源: 题型:
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①2NO(g)![]() N2(g)+O2(g) △H1=-180.5 kJ·mol-1
N2(g)+O2(g) △H1=-180.5 kJ·mol-1
②CO(g)+![]() O2(g)
O2(g)![]() CO2(g) △H2=-283 kJ·mol-1
CO2(g) △H2=-283 kJ·mol-1
则NO与CO反应生成两种无毒气体的热化学方程式为________________。
(2)使用高效催化剂可大大减少汽车尾气排放出的NOx含量,某研究所的科研人员探究了T1℃时等质量的三种催化剂对CO还原NO的催化效果(其他条件相同),所得结果如图1所示。

①如果不考虑催化剂价格,则使用催化剂____(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成CO的速率大小关系是_____。
②若容器容积为2 L,开始时加入0.5 mol NO、0.5 mol CO,在催化剂Ⅰ的作用下达到如图1所示平衡,则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在该温度下的平衡常数K=____L·mol-1。
N2(g)+2CO2(g)在该温度下的平衡常数K=____L·mol-1。
③在图2坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(NO转化率)与温度的关系图____。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB![]() cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应NO2(g)+CO(g)![]() NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.____=NO3+_____;Ⅱ.略,这两个反应中活化能较小的是___。
NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.____=NO3+_____;Ⅱ.略,这两个反应中活化能较小的是___。
②某科研小组测得380℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:

则该温度下的反应速率常数k=____L·mol-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月,在世界移动通信大会(MWC)上,发布了中国制造首款5G折叠屏手机的消息。手机电池的工作原理是LiCoO2+C=Li1-xCoO2+LixC 下列说法不正确的是( )

A.制造手机芯片的关键材料硅,是非金属元素
B.用铜制作的手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.这种手机电池工作时,没有氧化还原反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。

(1)该反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=________kJ/mol (用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量______(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1_______,E2________ΔH______ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[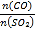 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
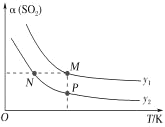
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,正确的是
A. 新制氯水中只含Cl2和H2O分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过排饱和食盐水,用大试管收集体积比为1∶1的甲烷和氯气混合气(如图),强光照射下发生反应。下列说法错误的是( )

A.试管中气体颜色变浅
B.试管内液面慢慢上升
C.水槽中的液体溶有氯化氢
D.试管内壁的油滴是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸丁酯的装置如图。下列对该实验的认识正确的是( )
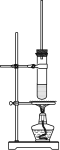
A.采用空气浴加热,石棉网可以避免局部温度过高
B.试管上方长导管的作用是让反应产生的气体逸出
C.反应结束后混合液下层呈油状且有果香味
D.欲提纯乙酸丁酯,需使用水、氢氧化钠溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种有机物Q(![]() )与P(
)与P(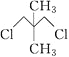 ),下列有关它们的说法中正
),下列有关它们的说法中正
确的是( )
A.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶1
B.二者在NaOH醇溶液中均可发生消去反应
C.一定条件下,二者在NaOH溶液中均可发生取代反应
D.Q的一氯代物只有1种、P的一溴代物有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com