
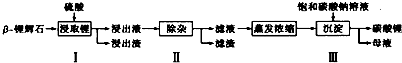
���� ��֪��-﮻�ʯ����Ҫ�ɷ�ΪLi2O•Al2O3•4SiO2��Ϊԭ�����Ʊ�Li2CO3�Ĺ������̣�Li2O•Al2O3•4SiO2�����ᣬ��ȡ�������õ���������Һ�к���Li+��SO42-��������Al3+��Fe3+��Fe2+��Mg2+��Ca2+��Na+�����ʣ����ڽ����¼���ʯ��ʯ����pH��ʹAl3+��Fe3+ת��Ϊ����������������ˣ��ٽ�������H2O2��Һ��ʯ�����Na2CO3��Һ���μ������Һ�У�Fe2+������ΪFe3+��Ȼ��ת��Ϊ��������������þ����ת��Ϊ������þ������������ת��Ϊ̼��Ƴ��������˵��������Һ���ټӱ���̼������Һ�õ�̼��﮳��������˵õ�̼��ﮣ�
��1���ӷ�Ӧ���ʵĽǶ���������
��2��ץס��Ŀ�еġ�������Һ������������Һ��pH��6.0��6.5�����������Լ���ѡ�����������ҩƷ��
��3��H2O2��ǿ���������ɰ�Fe2+������Fe3+��ʯ�����̼���ƶ��dz�������ʹ��Һ�е�Fe2+��Mg2+��Ca2+������
��4������Li2SO4��LiOH��Li2CO3��303K�µ��ܽ�ȷֱ�Ϊ34.2g��12.7g��1.3g��֪��Li2CO3���׳�����
��� �⣺��֪��-﮻�ʯ����Ҫ�ɷ�ΪLi2O•Al2O3•4SiO2��Ϊԭ�����Ʊ�Li2CO3�Ĺ������̣�Li2O•Al2O3•4SiO2�����ᣬ��ȡ�������õ���������Һ�к���Li+��SO42-��������Al3+��Fe3+��Fe2+��Mg2+��Ca2+��Na+�����ʣ����ڽ����¼���ʯ��ʯ����pH��ʹAl3+��Fe3+ת��Ϊ����������������ˣ��ٽ�������H2O2��Һ��ʯ�����Na2CO3��Һ���μ������Һ�У�Fe2+������ΪFe3+��Ȼ��ת��Ϊ��������������þ����ת��Ϊ������þ������������ת��Ϊ̼��Ƴ��������˵��������Һ���ټӱ���̼������Һ�õ�̼��﮳��������˵õ�̼��ﮣ�
��1���������ԽС����ѧ��Ӧ����Խ�죬ͬʱ��ʹ�Ԫ�ؾ����ܶ���ܽ���У�
�ʴ�Ϊ�������Һ�Ӵ�������ӿ������Ӧ���ʣ���߽����ʣ�
��2���������������У�ֻ��CaCO3�ܹ�������Һ����ȣ������Һ��pH��6.0��6.5���ɳ�ȥFe3+��Al3+��
�ʴ�Ϊ��ʯ��ʯ��
��3��������м���H2O2��Һ���ɽ�Fe2+����ΪFe3+��Ȼ�����ʯ����ɳ�ȥ���е�Fe3+��Mg2+���ټ�������Na2CO3��Һ�ɳ�ȥCa2+����ʱ��Һ�е�������Ҫ��Li+��Na+��SO42-��H2O2������Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2 H+=2Fe3++2H2O��
�ʴ�Ϊ��Fe2+��Mg2+��Ca2+��2Fe2++H2O2+2 H+=2Fe3++2H2O��
��4���������뱥��Na2CO3��Һ����ҪʹLi+ת��ΪLi2CO3������
�ʴ�Ϊ��2Li++CO32-=Li2CO3����
���� �ơ���������ͭ���仯�������ճ������зdz���Ҫ�����ʣ��ر����������ڹ�����ռ�м�����Ҫ�ĵ�λ��������ص㽫���Ƽ��仯����ر���Na2O2��Na2CO3��NaHCO3�������ʡ������仯��������ԡ�Fe2+��Fe3+֮���ת����ϵ��ͭ��ұ����Cu��OH��2�����ʵȣ������Ժ�߿����⽫����ѡ�����������ӹ��桢���ӷ���ʽ��������ԭ��Ӧ�����ʵļ��������ȽǶȿ������Ԫ�ؼ��仯��������ʣ�Ҳ���ڷ�ѡ�������Խ���Ԫ�ص�����Ϊ���壬ͨ���ƶ��⡢ʵ���⣬���鿼�����ý���Ԫ�ص��й�֪ʶ��������������������ʵ��̽������ʽ����Ԫ�ػ���������ʽ���Ϊ�Ժ�߿�����������㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����10s | B�� | ����10s | C�� | С��10s | D�� | ���ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij��ɫ��Һ�п��ܺ���SO42-��Br-��OH-��Ba2+ | |
| B�� | ʹ��ɫʯ����Һ���ɫ����Һ�п��ܺ���K+��Na+��Ba2+��HCO3- | |
| C�� | ij��Һ�У��������������ų�����Һ�п��ܺ���K+��Na+��H+��NO3- | |
| D�� | ��c��H+��=10-14mol/L����Һ�п��ܺ���Na+��AlO2-��CO32-��SO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
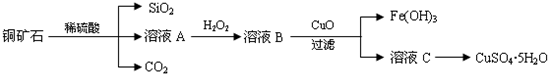
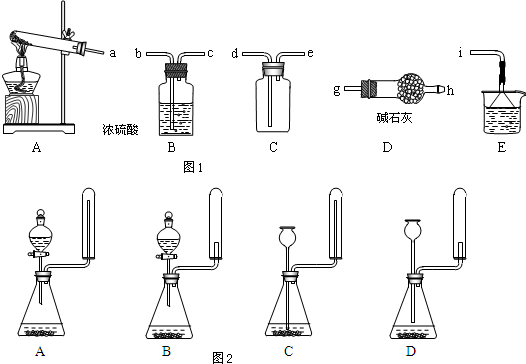
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | ʵ����� | ʵ������ | ʵ����� |
| �� | ����a����μ���H2SO3��Һ������ | ��ƿ����Һ�ɳȻ�ɫ��Ϊ��ɫ | Br2�������Դ���H2SO3 |
| �� | �����������Һ����μ���H2O2��Һ | �տ�ʼ��Һ��ɫ�����Ա仯�������μӣ���Һ��Ϊ�Ȼ�ɫ | H2O2�������Դ���Br2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

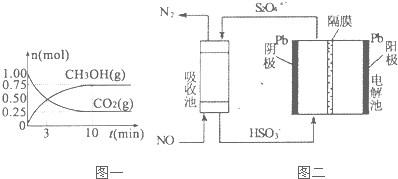
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1�� | n��CH4�� | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2�� | n��CH4�� | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2 mol•L-1��ˮ�У�c��OH-����c��NH4+����� | |
| B�� | 0.1 mol/L��Na2S��Һ�У�c��OH-��=c��H+��+c��HS-��+c��H2S�� | |
| C�� | pH=3��һԪ���pH=11��һԪ��������ͺ����Һ��һ����c��OH-��=c��H+�� | |
| D�� | 10mL0.02mol•L-1HCl��Һ��10mL0.02mol•L-1Ba��OH��2��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20 mL������Һ��pH=12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com