
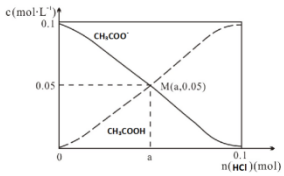
| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
分析 A.CH3COO-水解促进水的电离,CH3COOH电离出氢离子抑制水的电离;
B.根据电荷守恒计算;
C.根据水解常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$结合CH3COOH浓度的变化分析;
D.当n(HCl)=0.1mol时,CH3COONa与HCl恰好反应生成NaCl和CH3COOH,溶液显酸性.
解答 解:A.CH3COO-水解促进水的电离,CH3COOH电离出氢离子抑制水的电离,原溶液为醋酸钠溶液,醋酸根离子水解促进水的电离,M点溶液显酸性,醋酸电离的氢离子抑制水的电离,所以M点溶液中水的电离程度比原溶液小,故A正确;
B.在M点时,溶液中存在电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(CHCOO-)+c(OH-),则c(H+)-c(OH-)=c(Cl-)+c(CHCOO-)-c(Na+)=a+0.05-0.1=(a-0.05)mol/L,故B错误;
C.温度不变,水解常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小,故C正确;
D.当n(HCl)=0.1mol时,CH3COONa与HCl恰好反应生成等浓度的NaCl和CH3COOH,由于CH3COOH部分电离溶液显酸性,所以c(Na+)=c(Cl-)>c(CH3COOH)>c(H+)>c(CHCOO-)>c(OH-),故D正确.
故选B.
点评 本题考查弱电解质的电离以及盐的水解等方面的知识,注意把握溶液中的电荷守恒、影响水的电离平衡因素的分析判断,注意知识的归纳和梳理是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题

| A. | 装置②的待镀铁制品应与电源正极相连 | |
| B. | 装置①中阴极上析出红色固体 | |
| C. | 装置③闭合开关后,外电路电子由a极流向b极 | |
| D. | 装置④的X电极是外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③⑤ | C. | ①②④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
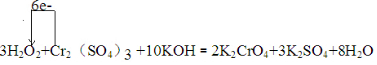 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫元素被氧化,所有铁元素均被还原 | |
| B. | 当转移1mol电子时,46 g CuFeS2参加反应 | |
| C. | 氧化产物是S,还原产物是Cu2+和Fe2+ | |
| D. | 还原剂是S2-,氧化剂是Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g | B. | 2.93g | C. | 1.15g | D. | 4.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
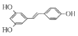 )具有预防心血管疾病的作用,其一种合成路线如图:
)具有预防心血管疾病的作用,其一种合成路线如图: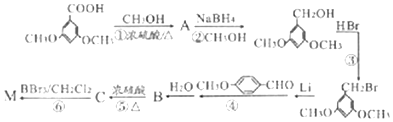
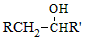
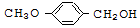 $\stackrel{BBr_{3}/CH_{2}Cl_{2}}{→}$
$\stackrel{BBr_{3}/CH_{2}Cl_{2}}{→}$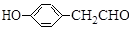 回答下列问题:
回答下列问题: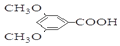 核磁共振氢谱中不同化学环境的氢原子个数比为6:1:2:1.
核磁共振氢谱中不同化学环境的氢原子个数比为6:1:2:1. .
. .
.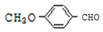 有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有3种.
有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有3种.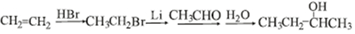 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>Y | |
| B. | Z的单质保存在X2Y中 | |
| C. | ZYX溶液和ZXW溶液都呈碱性,且原理相同 | |
| D. | 室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液的pH为2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com