
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.02 | 20.00 | 24.98 |
| 实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 双氧水(mL) | 0.5 | 0.4 | 0.6 | 0.5 | |||
| pH | 11 | 11 | 11 | 10 | |||
| 反应时间 | 3 | 3 | 3 | 3 |
分析 I.(1)过氧化氢能电离出氢离子而使其溶液呈弱酸性,酸式滴定管盛放酸性溶液,碱式滴定管盛放碱性溶液;
(2)配制一定物质的量浓度溶液需要容量瓶、胶头滴管、烧杯、玻璃棒;
(3)①该反应中Mn元素化合价由+7价变为+2价、O元素化合价由-1价变为0价,转移电子数为10;
②表格中第三次数据错误舍去,根据高锰酸钾和双氧水之间的关系式计算双氧水的质量,再根据质量分数公式计算其质量分数;
(4)A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失,导致高锰酸钾溶液体积偏大,高锰酸钾溶液浓度不变,则高锰酸钾的物质的量偏大;
B.将H2O2溶液配制成250.00mL溶液时,定容俯视刻度线,导致溶液体积偏小,根据c=$\frac{n}{V}$计算溶液浓度;
C.判断终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液再滴一滴H2O2溶液仍呈红色,说明加入的高锰酸钾的体积偏大,高锰酸钾的物质的量偏大;
II.(5)该反应中双氧水中O元素化合价的化合价由-1价变为0价,则双氧水作还原剂;
(6)双氧水不稳定,受热易分解生成氧气
(7)表格中双氧水的浓度必须是0.5,pH=11,反应时间=3,依题意:本题是单一变量的对比试验,而且双氧水的浓度已试验序号1,2,3研究了,因此现只研究PH和反应时间.
解答 解:I.(1)酸式滴定管盛放酸性溶液,碱式滴定管盛放碱性溶液,过氧化氢能电离出氢离子而使其溶液呈弱酸性,所以量取双氧水的滴定管应该用酸式滴定管,
故答案为:B;
(2)配制一定物质的量浓度双氧水溶液还需要250mL容量瓶、胶头滴管定容,故答案为:250mL容量瓶、胶头滴管;
(3)①该反应中Mn元素化合价由+7价变为+2价,高锰酸根离子作氧化剂,则双氧水作还原剂,O元素化合价由-1价变为0价,所以有氧气生成,转移电子数为10,根据转移电子及原子守恒配平方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2;5;6;2;8;5O2↑;
②该小组一共进行了四次测定实验,根据实验结果记录,表格中第三次数据错误舍去,滴定三次,平均耗用c mol/L KMnO4标准溶液25mL,
设参加反应的双氧水的质量为x,
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
2mol 170g
C×25×10-3mol x
2mol:170g=C×25×10-3mol:x
x=$\frac{25×170×C×1{0}^{-3}}{2}$g,
其质量分数=$\frac{25mL}{250mL}$×$\frac{25×170×C×1{0}^{-3}}{\frac{2}{10ρ}}×100%$=$\frac{1700C}{8ρ}%$,
故答案为:$\frac{1700C}{8ρ}%$;
(4)A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失,导致高锰酸钾溶液体积偏大,高锰酸钾溶液浓度不变,则高锰酸钾的物质的量偏大,导致测定双氧水的值偏高;
B.将H2O2溶液配制成250.00mL溶液时,定容俯视刻度线,导致溶液体积偏小,根据c=$\frac{n}{V}$知,导致物质的量浓度偏高;
C.判断终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液再滴一滴H2O2溶液仍呈红色,说明加入的高锰酸钾的体积偏大,高锰酸钾的物质的量偏大,导致测定双氧水的值偏高,
故选ABC;
II.(5)该反应中双氧水中O元素化合价的化合价由-1价变为0价,则双氧水作还原剂,还原剂体现还原性,
故答案为:还原;
(6)双氧水不稳定,受热易分解生成氧气,其操作是:取适量过氧化氢溶液于试管中加热,用带火星木条于试管口,木条复燃,
故答案为:取适量过氧化氢溶液于试管中加热,用带火星木条于试管口,木条复燃;
(7)表格中双氧水的浓度必须是0.5,pH=11,反应时间=3,依题意:本题是单一变量的对比试验,而且双氧水的浓度已试验序号1,2,3研究了,因此现只研究PH和反应时间.表格中双氧水的浓度必须是0.5,pH有两个11,一个大于11即可,可以是12、13等.反应时间必须大于、等于、小于3各一个.
故答案为:
| 5 | 6 | 7 |
| 0.5 | 0.5 | 0.5 |
| 11 | 11 | 12(>11即可) |
| 4(>3即可) | 2(<3即可) | 3 |
点评 本题考查探究物质的含量测定及性质实验方案设计,侧重考查学生实验操作、知识运用能力,涉及方程式的配平、滴定实验、氧化还原反应、物质检验、仪器使用等知识点,明确实验原理是解本题关键,难点是误差分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 雪是由水蒸气凝华而成的,该过程有能量放出 | |
| B. | 雪融化为水后能量增加 | |
| C. | 雪融化为水时要吸收能量,导致环境温度升高 | |
| D. | 在雪上撒大量的盐(如NaCl、MgCl2等)可以融雪 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| B. | 烷烃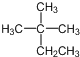 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| C. | 如图所示的有机物分子式为C14H12O2,能发生银镜反应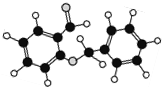 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 将CO2通入Na2SiO3溶液中,有白色沉淀生成 | 酸性:H2CO3>H2SiO3 |
| ⑥ | 向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀 | 该溶液中一定有SO42- |
| A. | ①②⑥ | B. | ①④⑤ | C. | ②③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用FeCl3溶液可以鉴别化合物X和Y | |
| B. | Y的苯环上的二氯取代物有8种同分异构体 | |
| C. | 在NaOH水溶液中加热,化合物X发生消去反应 | |
| D. | X转化为Y的反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾固体(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | 氯气(氯化氢) | 饱和氯化钠溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有② | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com