
分析 (1)根据铁、氧化铁都能与盐酸反应以及反应后溶液中无Fe3+,所以铁也与硫酸铁反应,先根据H2求出和硫酸生成1.68LH2的铁,然后根据混合物发生的反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe2(SO4)3+Fe=3FeSO4,可知n(Fe2O3):n(Fe)=1:1,求出Fe2O3和Fe的质量,最终求出混合物中Fe和Fe2O3的质量;
(2)由题意我们应该可以理解反应后溶液中只有Fe 2+而无Fe3+,而且硫酸有剩余,也就说固体与酸反应后溶液中得到的是FeSO4和硫酸的混合液,接着在这混合溶液中滴加NaOH溶液,先中和了硫酸,又与 FeSO4反应生成了Fe(OH)2沉淀,最终溶液中剩余物质其实就是Na2SO4.这样我们用守恒法考虑,SO4 2-来自原H2SO4,而Na+来自NaOH,这样得到H2SO4~2NaOH,最后根据c=$\frac{n}{V}$求出原硫酸的物质的量浓度.
解答 解:(1)因铁、氧化铁都能与硫酸反应:Fe+H2SO4=FeSO4+H2↑ Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,又因反应后溶液中无Fe3+,所以有反应为:Fe+Fe2(SO4)3=3FeSO4,
1.68L氢气的物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,根据反应Fe+H2SO4=FeSO4+H2↑可知与硫酸生成1.68LH2消耗的铁为0.075mol,其质量为:56g/mol×0.075mol=4.2g,剩余混合物质量为:15-4.2=10.8g,剩余的混合物发生如下反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4可得关系式Fe2O3~Fe2(SO4)3~Fe,所以剩余混合物中Fe2O3和Fe的物质的量应该为1:1,设二者物质的量都为n,则160n+56n=10.8g,解得:n=0.05mol,则m(Fe2O3)=160g/mol×0.05mol=8g,m(Fe)=56g/mol×0.05mol=4.2,原混合物中铁的质量为:4.2g+2.8=7g,
答:原混合物中含有7gFe,4.2gFe2O3;
(2)因为反应后溶液中无Fe3+存在,且固体没有剩余,则全都是以Fe2+的形式存在,反应后溶质为硫酸亚铁,根据质量守恒定律可知:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=3mol/L×0.2L×$\frac{1}{2}$=0.3mol,
所以原稀H2SO4的物质的量浓度为:$\frac{0.3mol}{0.15L}$=2mol/L,
答:原稀H2SO4的物质的量浓度为2mol/L.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 4:3:2 | C. | 4:3:4 | D. | 1:5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
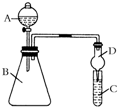 某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验.
某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑥ | C. | ①⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com