
分析 (1)钠暴露在空气中和氧气反应生成氧化钠而变暗;
(2)钠和水反应生成氢氧化钠和氢气且放出热量,钠和水反应生成氢氧化钠和氢气,随着反应的进行水的量减少,氢氧化钙溶液成为过饱和溶液,溶液中析出部分氢氧化钙,因为有氢氧化钠的存在,抑制氢氧化钙的溶解;
(3)根据钠与水反应生成氢氧化钠和氢气,氢气和转移电子之间的关系式计算;
(4)根据钠比较活泼,密度比煤油大保存钠.
解答 解:(1)钠放置在空气中和氧气反应生成氧化钠而变暗,反应方程式为:4Na+O2═2Na2O,故答案为:4Na+O2═2Na2O;
(2)A.钠和水反应生成氢气,所以能观察到,故A错误;
B.钠的熔点较低且钠和水反应放出大量的热使钠熔成小球,所以能观察到,故B错误;
C.钙的活泼性大于钠,且钠、钙都易和水反应生成碱,所以钠不可能置换出钙,则看不到有金属钙生成,故C正确;
D.因为有部分溶质析出而导致溶液成悬浊液,所以看到溶液变浑浊,故D错误;
故选C;
(3)钠与水反应生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,224mL氢气的物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,转移电子的物质的量=0.01mol×2×(1-0)=0.02mol,故答案为:2Na+2H2O=2Na++2OH-+H2↑;0.02mol;
(4)因为钠比较活泼,密度比煤油大,所以应保存在煤油中,故答案为:煤油.
点评 本题考查了钠的性质,题目难度不大,根据钠的物理性质和化学性质分析钠和水反应现象,注意掌握钠投入盛有饱和石灰水的烧杯中的反应实质.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| B. | 向稀硫酸溶液中撒入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑ | |
| D. | 向氢氧化钠溶液中通入少量二氧化碳 2OH-+CO2=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)过氧化氢是一种二元弱酸,比碳酸的酸性还弱.
(1)过氧化氢是一种二元弱酸,比碳酸的酸性还弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中,先加入氯水后滴入KSCN溶液,若溶液呈红色,则说明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取待测液放在火焰上灼烧,若火焰呈黄色,则说明待测液中含有钠离子,不含钾离子 | |
| C. | 分液时,分液漏斗中下层液体从下口放出后,将上层液体从上口倒入另一个洁净的烧杯中 | |
| D. | 蒸馏时,应将温度计的水银球插入蒸馏烧瓶内的混合液体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
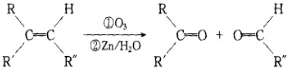
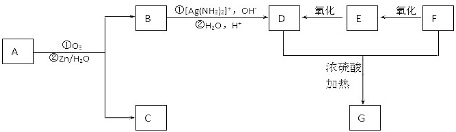
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 蒸馏实验时,冷水从冷凝管下口入,上口出 | |
| C. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| D. | 萃取实验时,应先后将上下两层液体从下口放出,并用不同烧杯盛放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com