
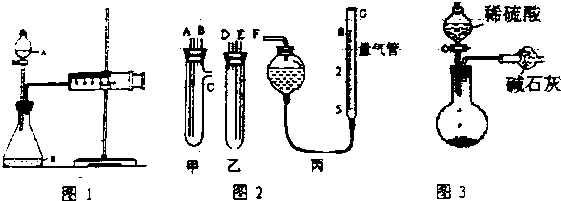
分析 (1)根据速率的表达式v=$\frac{△c}{△t}$判断需要测量数据;使装置内外形成气压差是气密性检查的常用手段;
(2)①由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸;
②图中量气装置和碱式滴定管相似;
③连接导管时,应用A连接D,B连接E,C连接F;
④读数时应使丙装置内外气压相等,故读数前应使左右两边液面相平;滴定管内测量前后溶液体积变化为气体体积,俯视时,读取的液面的数值比实际偏小变.
(3)根据碱石灰的成分可知,碱石灰既可吸收二氧化碳也可吸收水,以及干燥管与空气接触等进行分析即可.
解答 解:(1)根据速率的表达式v=$\frac{△c}{△t}$判断需要测量数据,通过分液漏斗加入1mol•L-1稀硫酸40mL,收集10mL气体可计算硫酸浓度变化,故还需知道反应时间;使装置内外形成气压差是气密性检查的常用手段,检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好,
故答案为:反应时间;关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)①由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸;
②G为量气装置,根据构造,可用碱式滴定管代替;
③连接导管时,应用A连接D,B连接E,C连接F;
④读数时应装置内外气压相等,读数前应上下移动滴定管,使左右两边液面相平;俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大,导致所测气体的体积偏大;
故答案为:甲;乙;碱式滴定管;D、E、F;上下移动滴定管,使左右两边液面相平;偏大;
(3)因生产的CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,会导致质量偏大,
故答案为:CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中.
点评 本题考查物质的含量测定的实验设计,侧重于考查学生分析能力和实验能力,题目较为综合,为高考常见题型,注意把握实验原理和操作方法,题目难度中等.


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
 VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )| A. | 放电时正极反应为:VO${\;}_{2}^{+}$+2H++e-═VO2++H2O | |
| B. | 充电过程中,H+由阴极区向阳极区迁移 | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电时阴极反应为:V2+-e-═V3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是组成中含有氢元素的化合物都属于酸 | |
| B. | 凡是组成中含有OH-的化合物都属于碱 | |
| C. | 酸和碱中至少含有一种相同的元素 | |
| D. | 酸和碱中都含有金属阳离子和阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na完全转化生成Na2O和Na2O2,失去电子数为NA 到2NA之间 | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 含2mol H2SO4的浓硫酸与足量铜微热反应,生成SO2分子数为NA | |
| D. | 粗铜精炼时转移1mol电子,阳极上溶解的Cu原子数一定为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | BaCl2 | C. | AgNO3 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g H2O中含有的原子总数为3NA | |
| B. | 在标准状况下,22.4L苯的物质的量为1mol | |
| C. | 1mol/L NaOH溶液中含有的Na+数为NA | |
| D. | 22gCO2与标准状况下11.2LHCI所含的分子数不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com