
科目:高中化学 来源: 题型:解答题
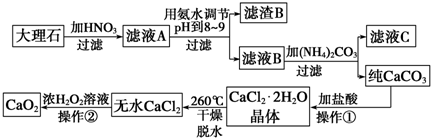
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
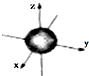
| A. | 3d3表示3d能级上有3个轨道 | |
| B. | ns能级的原子轨道图都可以用右图表示 | |
| C. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| D. | 电子云图的黑点密度越大,说明核外空间电子数越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
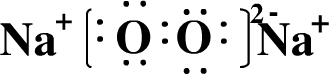 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
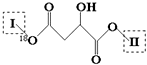 (其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
(其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
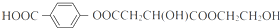 .
. .
.
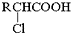 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH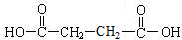 .
.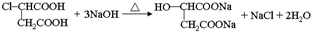 .
.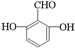 、
、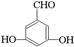 、
、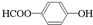 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH=CH2 | B. | CH3(CH2)2CH(CH3)2 | C. | CH3CH2OH | D. | CH3C≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com