
| A、n=3时,则分子的立体构型为V形 |
| B、n=2时,则分子的立体构型平面三角形 |
| C、n=4时,则分子的立体构型为正四面体形 |
| D、n=4时,则分子的立体构型为三角锥形 |
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| A、用米汤检验含碘盐中的碘酸钾(KIO3) |
| B、用食醋除去暖水瓶中的薄层水垢 |
| C、用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
| D、用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸与KMnO4反应制取Cl2 |
| B、向蔗糖中加入浓H2SO4,固体变黑膨胀 |
| C、用稀硫酸与CuO反应制取胆矾 |
| D、用浓硝酸除去铝表面的铜镀层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、HCO3-、H+ |
| B、Fe2+、Fe3+、Na+、NO3- |
| C、OH-、Na+、HCO3-、SO42- |
| D、Ba2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性:F>O>S |
| B、稳定性:SiH4>PH3>H2S |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
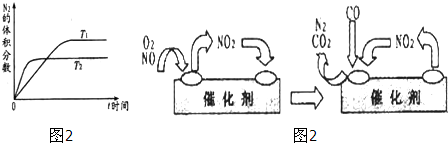
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com