
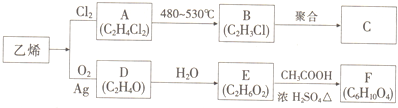

分析 乙烯与氯气加成生成A为ClCH2CH2Cl,加入发生消去反应生成B为CH2=CHCl,B发生加聚反应得到C为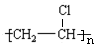 .乙烯与氧气反应生成D(C2H4O),D为环氧乙烷
.乙烯与氧气反应生成D(C2H4O),D为环氧乙烷 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯( ),据此解答.
),据此解答.
解答 解:乙烯与氯气加成生成A为ClCH2CH2Cl,加入发生消去反应生成B为CH2=CHCl,B发生加聚反应得到C为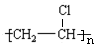 .乙烯与氧气反应生成D(C2H4O),D为环氧乙烷
.乙烯与氧气反应生成D(C2H4O),D为环氧乙烷 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯( ).
).
(1)由乙烯生成A的反应类型为:加成反应,故答案为:加成反应;
(2)C是一种常见的塑料,结构简式为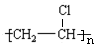 ,化学名称为聚氯乙烯,故答案为:聚氯乙烯;
,化学名称为聚氯乙烯,故答案为:聚氯乙烯;
(3)D是环状化合物,其结构简式为: ,故答案为:
,故答案为: ;
;
(4)①A→B的反应方程式为:ClCH2CH2Cl$\stackrel{480-530℃}{→}$CH2=CHCl+HCl,
②E→F的反应方程式为:HOCH2CH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
故答案为:ClCH2CH2Cl$\stackrel{480-530℃}{→}$CH2=CHCl+HCl;HOCH2CH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,根据乙烯与D的分子式与转化关系,判断D的结构是解题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
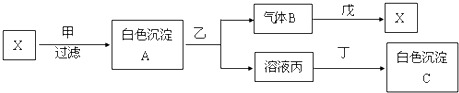
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n=5 | B. | n<5 | C. | n>5 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
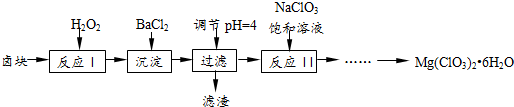
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com