
| A. | 分子组成相同的化合物 | B. | 分子构造相同的化合物 | ||
| C. | 分子组成相同而构造不同的化合物 | D. | 分子组成与构造都不相同的化合物 |
科目:高中化学 来源: 题型:解答题
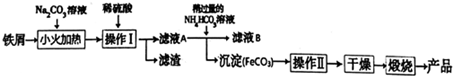
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 其分子式为C15H22O4 | |
| B. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol | |
| C. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
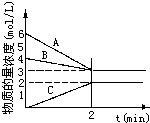 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
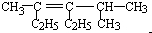 2,4-二甲基-3-乙基-3-己烯
2,4-二甲基-3-乙基-3-己烯  3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯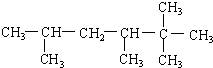 2,2,3,5-四甲基己烷.
2,2,3,5-四甲基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能发生银镜反应的物质不一定是醛 | |
| B. | 酯在碱性条件下的水解生成相应的羧酸和醇 | |
| C. | 参与酯化反应的物质一定有两种 | |
| D. | 苯酚中羟基对苯环的影响是使苯环上氢原子都变的很活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com