
已知:25℃时,Ksp(AgCl)>Ksp(AgI),下列叙述不正确的是
A.AgI悬浊液中存在平衡:AgI(s)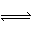 Ag+(aq)+I- (aq)
Ag+(aq)+I- (aq)
B.25℃时,向AgCl的悬浊液中加入NaCl固体,AgCl的溶度积常数不变
C.向含KC1、NaI的混合溶液中滴入AgNO3溶液,一定先析出AgI沉淀
D.用等体积的水和氯化钠溶液分别洗涤AgCl沉淀,水洗造成的AgCl损耗大
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
氢有三种同位素: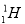 、
、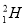 和
和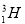 ,它们之间存在差异的是
,它们之间存在差异的是
A.质子数 B.中子数 C.电子数 D.原子序数
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考文科化学试卷(解析版) 题型:选择题
合金在生产及科研中具有广泛的应用。下列物质属于合金的是
A.水银 B.石墨 C.硅晶体 D.不锈钢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:填空题
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)

 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)右图表示NO2的变化的曲线是_______。用O2表示从0~2 s内该反应的平均速率v=_______________。
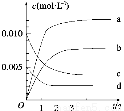
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
下图是CO2电催化还原为CH4的工作原理示意图。
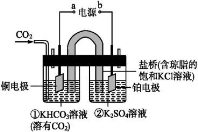
下列说法不正确的是
A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e- CH4+2H2O
CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.除去MgCl2溶液中少量的FeCl3,可选用MgCO3
B.等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度前者大于后者
C.NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-的水解程度增大,pH增大
D.用饱和氯化铵溶液可以清洗金属表面的锈迹
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:填空题
铁元素不仅可以与SCN-、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物.回答下列问题:
(1)基态铁原子有_____________个未成对电子;
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2
①C、N、O三种元素的第一电离能由大到小的顺序是_____________;
②1molFe(CN)32-中含有σ键的数目为_____________;
③铁与CO形成的配合物Fe(CO)3的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)3晶体属于_____________(填晶体类型)
(3)乙二胺四乙酸能和Fe2+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如图1:
①乙二胺四乙酸中碳原子的杂化轨道类型是_____________;
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_____________;
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成,小立方体如图2所示,则该合金的化学式为_____________,已知小立方体边长为acm,此铁铝合金的密度为_____________g•cm-3。

查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三最后一卷理综化学试卷(解析版) 题型:实验题
某研究性学习小组以甲酸为原料在实验室完成了一氧化碳和甲酸铜两种物质的制备实验。
实验一、用甲酸制备一氧化碳
CO的制备原理:HCOOH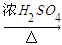 CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
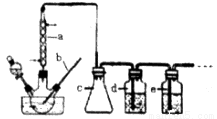
(1)b仪器的名称为___________,c的作用是___________。
(2)制备CO时,浓硫酸与甲酸的混合方式是___________。
实验二、用甲酸制备甲酸铜[Cu(HCOO)2•4H2O]
步骤一:碱式碳酸铜的制备
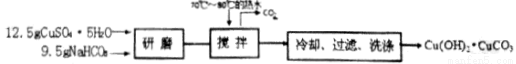
步骤二:甲酸铜的制备
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤,滤液在通风橱下蒸发至原体积的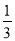 左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2•4H2O产品,称量,计算产率。回答下列问题:
左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2•4H2O产品,称量,计算产率。回答下列问题:
(3)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?___________。
(4)步骤二中碱式碳酸铜滴入甲酸生成四水合甲酸铜的化学方程式为___________。
(5)本实验涉及三种固液分离的方法.
①倾析法使用到的仪器有___________;
②采用减压过滤的装置对步骤二中溶解后的溶液进行趁热过滤;
③步骤二的实验中,需用到下列装置___________

(6)最终称量所得的产品为7.91g,则产率为___________。
查看答案和解析>>
科目:高中化学 来源:205-2016学年吉林省高二下学期期中化学试卷(解析版) 题型:选择题
下列描述正确的是( )
A.甲苯中若混有苯,可通过酸性高锰酸钾溶液除去
B.乙醇中是否混有水,可用加入金属钠是否产生气体进行检验
C.蚕丝和棉花的组成元素相同,分子结构不同,因而性质不同
D.乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com