
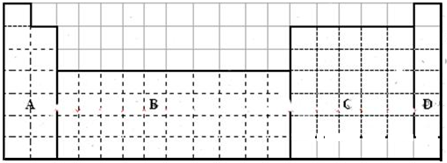
分析 (1)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素;
(2)过渡元素均为金属元素;
(3)第ⅢB族含有镧系元素、锕系元素;
(4)氧化铝属于两性氧化物;地壳中含量最多的金属元素是铝;通常状况呈液态的非金属单质是溴;
(5)同周期自左向右金属性逐渐减弱、非金属性逐渐增强.同主族自上而下原子金属性逐渐增强、非金属性逐渐减弱,金属性越强,与水反应越剧烈;非金属性越强,元素的气态氢化物越稳定,元素的最高价氧化物的酸性越强.
解答 解:(1)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素,画出金属和非金属的分界线为: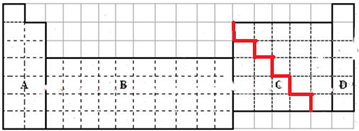 ,
,
故答案为: ;
;
(2)s区含有H元素,p区含有金属元素与非金属元素,过渡元素均为金属元素,为图中B区域,
故答案为:B;
(3)第ⅢB族含有镧系元素、锕系元素,是所含元素最多的族,
故答案为:第ⅢB族;
(4)第三周期中对应的最高价氧化物呈两性金属是铝,地壳中含量最多的金属元素是铝,通常状况呈液态的非金属单质是溴,
故答案为:铝;铝;溴;
(5)短周期中Na的金属性最强,与水反应最剧烈;非金属性越强,元素的气态氢化物越稳定,元素的最高价氧化物的酸性越强,F元素非金属性最强,故HF最稳定,F元素没有最高价含氧酸,最高价含氧酸最强为HClO4,
故答案为:Na;HF;HClO4.
点评 本题考查元素周期表的结构和元素周期律的应用,熟练掌握元素周期表结构,注意族与列的关系,从结构上理解同主族、同周期元素性质递变规律.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应 | B. | 酯化反应 | C. | 置换反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与乙醇反应不如与水反应活泼,体现了羟基对乙基的影响 | |
| B. | 在溴乙烷分子中,溴原子与乙基之间的影响是相互的 | |
| C. | 苯酚比苯更容易发生苯环上的取代反应,体现了羟基对苯基的影响 | |
| D. | 苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用,要在催化剂作用下才只得到一溴代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023称为阿伏加德罗常数 | |
| B. | 物质的量是用0.012千克碳中所含的原子数目作为标准来衡量其他微粒集体 | |
| C. | 标况下1mol氢气和氮气的混合气体的体积约为22.4L | |
| D. | 用单位体积的溶剂中所含溶质的物质的量表示溶液组成的物理量叫溶质的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| A | 0.7137g/mL | -116.6 | 34.5 | 不溶于水 |
| B | 0.7893g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
| A. | 蒸馏 | B. | 过滤 | ||
| C. | 萃取 | D. | 加水充分振荡,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
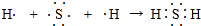 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com