
|
下图表示某反应N2(g)+3H2(g)
| |
A. |
t0-t1 |
B. |
t2-t3 |
C. |
t3-t4 |
D. |
t5-t6 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:阅读理解

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
| [N2O4] |
查看答案和解析>>
科目:高中化学 来源:三点一测丛书 高中化学(选修)化学反应原理 江苏版课标本 江苏版课标本 题型:021
|
下图表示某反应在一段时间内,当其他条件不变时,改变某一反应条件对反应物转化率的影响.由t1→t2为升高温度,由t2→t3为增加压强,符合此图像的反应是
| |
A. |
N2(g)+3H2(g) |
B. |
N2O3(g) |
C. |
ClF(g)+F2(g) |
D. |
N2(g)+O2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
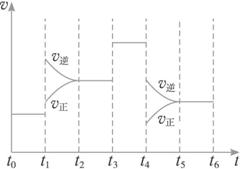
A.t0—t1 B.t2—t
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省烟台市高三上学期期末统考化学试卷(解析版) 题型:填空题
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。

③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com