
| A.① | B.③⑥ | C.②④⑥ | D.①③④ |
科目:高中化学 来源:不详 题型:单选题
| A.IA族金属元素是同周期中金属性最强的元素 | ||||
| B.不同元素的原子构成的分子中一定只含极性共价键 | ||||
C.
| ||||
| D.ⅦA族元素的简单阴离子还原性越强,其最高价氧化物对应水化物的酸性就越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.IA族即是碱金属元素 |
| B.VIIA族即是卤族元素 |
| C.短周期元素全部为主族元素 |
| D.元素周期表每个纵行即是一族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最高价氧化物对应水化物的酸性Z>Y |
| B.原子半径X>Y |
| C.一定条件下,Q可分别与X、Y、Z形成化合物,这些化合物都可溶于NaOH溶液 |
| D.元素Y的氧化物是形成酸雨的罪魁祸首 |
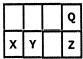
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com