
用NA表示阿伏伽德罗常数的值.下列叙述正确的组合是( )
①14g乙烯和丙烯的混合物中氢原子数为2NA个
②0.1mol•L﹣1的FeCl3溶液滴入沸水形成的胶体粒子的数目为0.1NA个
③标准状况下,2.24L Cl2通入足量的NaOH溶液中转移的电子数为0.1NA个
④25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣ 数目为0.2NA个
⑤常温下,100mL 1mol•L﹣1Na2CO3溶液中阴离子总数大于0.1NA个
⑥1mol Na2O2与足量水蒸气反应转移电子数为NA个
⑦常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA个.
A.①④⑤⑦ B. ②⑤⑥⑦ C. ①③⑤⑥ D. ①③⑤⑦
考点: 阿伏加德罗常数.
分析: ①乙烯和丙烯的最简式相同,都为CH2,以此计算;
②根据FeCl3溶液的体积不明确以及氢氧化铁胶体是氢氧化铁的聚集体判断;
③1molCl2通入足量的NaOH溶液中转移的电子数为NA个;
④依据PH计算氢离子浓度,结合溶液中离子积常数计算碱溶液中氢氧根离子浓度,水溶液中水电离也生成氢氧根离子分析判断;
⑤碳酸根离子水解生成氢氧根离子和碳酸氢根离子;
⑥过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应过氧化钠中O元素化合价由﹣1价变为﹣2价和0价;
⑦铝在浓硫酸中发生钝化.
解答: 解:①乙烯和丙烯的最简式相同,都为CH2,14g乙烯和丙烯的混合物中氢原子数为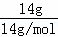 ×2NA/mol=2NA,故①正确;
×2NA/mol=2NA,故①正确;
②FeCl3溶液体积不明确,故无法知道FeCl3的物质的量;而且FeCl3加入到沸水中后氢氧化铁胶体是氢氧化铁的聚集体,故无法判断形成的胶粒的个数,故②错误;
③2.24L Cl2的物质的量是0.1mol,转移的电子数为0.1NA个,故③正确;
④25℃时,pH=13的1.0L Ba(OH)2溶液中,碱含有的OH﹣数目为0.2NA,水存在电离生成氢氧根离子,所以溶液中氢氧根离子大于0.2NA,故④错误;
⑤常温下,100mL 1mol•L﹣1 Na2CO3溶液中,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,阴离子总数大于0.1NA,故⑤正确;
⑥1mol过氧化钠和水反应转移电子数=1mol×1×NA/mol=NA,故⑥正确;
⑦铝在浓硫酸中发生钝化,2.7g铝片不能完全反应,故⑦错误;
故选C.
点评: 本题考查常用化学计量的有关计算,难度中等,转移气体摩尔体积的使用条件与对象.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3) /mol·L-1 | c(H2SO4) /mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时,探究温度对化学反应速率的影响,应选择__________(填实验编号);探究浓度对化学反应速率的影响,应选择__________(填实验编号);若同时选择①②③溶液变浑浊的同时,探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________________________________________________________,
甲同学设计如下实验流程探究Na2S2O 3的化学性质。
3的化学性质。
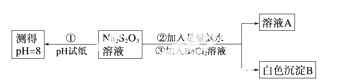
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是________(填“甲”或“乙”),理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程式表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有无色气体逸出,请写出相应的离子方程式: 。
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL 5mol•L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),往反应后溶液中滴加KSCN溶液,无明显现象,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能大量共存的是( )
|
| A. | Fe3+、SCN﹣、Na+、Cl﹣ | B. | Cl﹣、AlO2﹣、HCO3﹣、Na+ |
|
| C. | Fe2+、NH4+、SO42﹣、S2﹣ | D. | Ca2+、HCO3﹣、Cl﹣、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色 变灰暗
变灰暗 变白色
变白色 出现液滴
出现液滴 白色固体,下列说法正确的是( )
白色固体,下列说法正确的是( )
|
| A. | ①发生了氧化还原反应 |
|
| B. | ②变白色是因为生成了碳酸钠 |
|
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 |
|
| D. | ④只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2H2S(g)  2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
A.加入催化剂,反应路径将发生改变,ΔH也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,体系温度降低
D.恒容体系,充入H2重新达到平衡后,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
进行下列实验操作时,一般情况下不应该相互接触的是
A.用移液管移取10 mL NaOH溶液并放于锥形瓶中,移液管的尖嘴和锥形瓶的内壁
B.减压过滤时,布氏漏斗下端管口与吸滤瓶的内壁
C.实验室将HCl气体溶于水时,倒扣的三角漏斗口与烧杯内的水面
D.分液操作分出下层液体时,分液漏斗下端管口和烧杯的内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com