
【题目】下列各组物质中,均属于共价化合物并且化学键类型完全相同的是
A.N2 和 H2B.H2S 和 CO2C.O2 和 CCl4D.HNO3 和 NH4NO3
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )

A. I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B. “水”电池内Na+不断向负极作定向移动
C. 每转移1mole-,U型管中消耗0.5molH2O
D. “水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
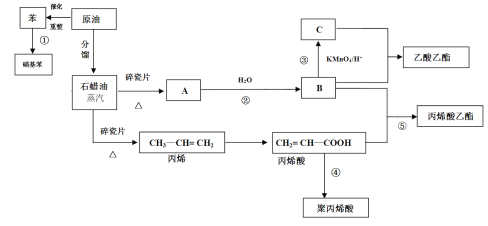
(1)C的结构简式为________。
(2)丙烯酸中含氧官能团的名称为_____________。
(3)③④反应的反应类型分别为_____________、___________。
(4)写出下列反应方程式
①反应①的化学方程式____________;
②反应②的化学方程式_________________;
③反应⑤的化学方程式____________。
(5)丙烯酸(CH2 = CH — COOH)可能发生的反应有_______________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(6)丙烯分子中最多有______个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在生产、生活中有广泛的应用,按要求回答问题:
(1)CO2可通过反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)转化成有机物实现碳循环。一定条件下,在体积为1 L的密闭容器中,充入 1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)转化成有机物实现碳循环。一定条件下,在体积为1 L的密闭容器中,充入 1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从3 min到9 min内,v(H2)=_____mol·L1·min1。平衡时H2的转化率为________。平衡时混合气体中CO2(g)的体积分数是________。一定温度下,第9分钟时v逆(CH3OH) _______第3分钟时v正(CH3OH)(填“大于”、“小于”或“等于”)。
(2)如图,将锌片、C棒通过导线相连,置于稀硫酸中。

该装置工作时,溶液中的SO42-向____极(填“C”或“Zn”)移动;电子沿导线流入_______极(填“C”或“Zn”)。写出正极的电极反应式____。若正极产生11.2L气体(标况下),则电路中应该有___mol电子发生了转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )

A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol/L的7种溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaHSO4 | NaClO |
pH | 12 | 9.7 | 12.3 | 10.0 | 6.0 | 1.0 | 10.3 |
请由上表数据回答:
(1)上述表中pH=12的Na2CO3溶液中水电离出的氢氧根离子浓度为:______ mol/L
(2)根据表中的数据分析,物质的量浓度均为0.1mol/L的Na2CO3、Na2SiO3、NaHCO3、NaHSO3溶液中水的电离程度最大的是:______________(填化学式)
(3)用适当的语言和化学用语分析NaHSO3溶液显酸性的原因:_____________
(4)用离子方程式说明Na2SO3溶液pH>7的原因________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com