
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
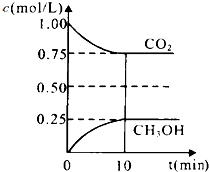 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g.向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g.向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | B. | 原混合酸中NO3-物质的量为0.1mol | ||
| C. | m值为9.6 | D. | H2SO4浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
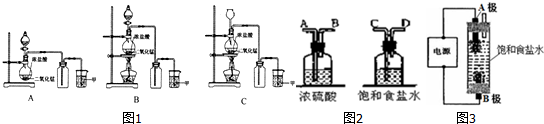
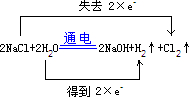 .有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).
.有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 细铁丝在氧气里点燃后剧烈燃烧,火星四射,产生黑色固体 | |
| B. | 氢气燃烧产生淡蓝色火焰 | |
| C. | 硫在空气中燃烧产生明亮的蓝紫色火焰,并生成有刺激性气味的气体 | |
| D. | 红磷在空气中燃烧产生大量白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子一定比原子大 | |
| B. | 所有原子的原子核都是由质子和中子构成 | |
| C. | 分子、原子、离子都是构成物质的粒子 | |
| D. | 物质状态发生变化,是因为粒子大小发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.
化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 氢氧燃料电池的能量转换形式之一为化学能转化为电能 | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com