
| A. | 煤矸石中的金属氧化物均溶于水,且都能与水反应 | |
| B. | 煤矸石含有的酸性氧化物对应的水化物中,酸性最强的是H3PO4 | |
| C. | 煤矸石可用于生产矸石水泥、耐火砖等建筑材料 | |
| D. | 用盐酸可以溶解煤矸石中的所有氧化物 |
分析 A、Al2O3、SiO2均难溶于水;
B、P2O5和SO3对应水化物的酸为磷酸、硫酸,硫酸酸性强;
C、煤矸石主要成分是Al2O3、SiO2,熔点高硬度大;
D、SiO2不能溶于盐酸.
解答 解:A、煤矸石主要成分是Al2O3、SiO2,Al2O3、SiO2均难溶于水,故A错误;
B、P2O5和SO3对应水化物的酸为磷酸、硫酸,硫酸为强酸,所以酸性较强的是H2SO4,故B错误;
C、煤矸石主要成分是Al2O3、SiO2,可用于生产矸石水泥、耐火砖等建筑材料,故C正确;
D、SiO2不能溶于盐酸,所以用盐酸可以溶解煤矸石中的部分氧化物如Al2O3,而SiO2不能溶,故D错误.
故选:C.
点评 本题考查了物质分类方法和物质性质的判断,主要是两性氧化物、碱性氧化物性质的分析判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
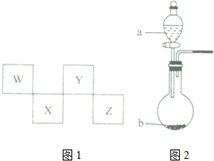 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物. ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| D. | C2H5OH(CH3COOH),加足量CaO,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示:
以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol N2所含有的原子数为NA | |
| B. | 1mol•L-1 NaCl溶液中含有的钠离子数目为NA | |
| C. | 标准状况下,22.4 LCO所含的原子数为NA | |
| D. | 12.4g白磷(分子式为P4)中含有磷原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+Cu2+=Fe2++Cu | B. | 2H2S+SO2=3S+2H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(X-) | C. | $\frac{c({H}^{+})}{c(HX)}$ | D. | $\frac{c(HX)}{c({H}^{+})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+KOH(aq)═KHSO3(aq)△H=-(4x-y)kJ/mol | |
| B. | SO2(g)+KOH(aq)═KHSO3(aq)△H=-(2x-y)kJ/mol | |
| C. | SO2(g)+KOH(aq)═KHSO3(aq)△H=-(2y-x)kJ/mol | |
| D. | 2SO2(g)+2KOH(1)═2KHSO3(1)△H=-(8x-2y)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com