
【题目】100mL浓度为2mol.L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 加入适量6 mol.L-1的盐酸
B. 加入少量醋酸钠固体
C. 加热
D. 加入少量金属钠
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。

①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | a | b | c | d |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:

i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH的Ca(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A. V3>V2=V1 B. V3=V2=V1 C. V3>V2>V1 D. V1=V2>V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)该浓盐酸中HCl的物质的量浓度为___________。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是( )
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL上述浓盐酸进行配制。
②配制时,除用到量筒、烧杯、玻璃捧外,还需要的仪器有___________。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度偏大的有_________
A.转移溶液后未洗涤烧杯和玻确棒就直接定容
B.在定容时仰视刻度线
C.在定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线
E.用量筒量取浓盐酸时俯视观察凹液面
(4)假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取________L盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是( )

A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C.反应①中,1mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了如下实验方案,操作流程如下:
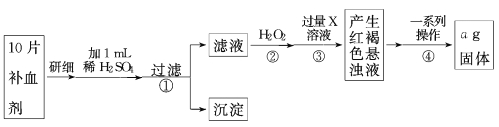
(1)写出步骤②中H2O2氧化Fe2+ 的离子方程式 。步骤②中除用H2O2外还可以使用的物质是 ;若步骤③中X溶液是氨水,写出该反应的离子方程式 。
(2)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(3)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com