
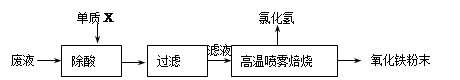
| ²Ł×÷²½Öč | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
| ²½Öč1£®Č”ÉŁĮæѳʷӌŹŌ¹ÜÖŠ£¬_________________ ____________________________________________ | ___________________________ |
| ²½Öč2£® ____________________________________________ | ___________________________ |
 Fe(OH)2 + 2HCl £Ø1·Ö£©
Fe(OH)2 + 2HCl £Ø1·Ö£©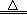 Fe2O3 + 3H2O £Ø1·Ö£¬Ā©Š“Ģõ¼ž²»µĆ·Ö£©
Fe2O3 + 3H2O £Ø1·Ö£¬Ā©Š“Ģõ¼ž²»µĆ·Ö£©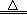 2 Fe2O3+8HCl £Ø3·Ö£¬Ā©Š“Ģõ¼žµĆ2·Ö£©
2 Fe2O3+8HCl £Ø3·Ö£¬Ā©Š“Ģõ¼žµĆ2·Ö£©| ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
| ²½Öč1£ŗ¼ÓČė×ćĮæµÄ3mol?L£1H2SO4£¬³ä·ÖÕńµ“”£ | ѳʷȫ²æČܽā |
| ²½Öč2£ŗȔɣŠķČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæĢś·Ū£¬³ä·ÖÕńµ“£»ŌŁ¼ÓČė×ćĮæ3mol?L£1H2SO4£¬³ä·ÖÕńµ“”£ | ŹŌ¹ÜÖŠ³öĻÖŗģÉ«¹ĢĢ壬ĖµĆ÷ŹŌŃłÖŠÓŠCuO |
| ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
| ²½Öč1£ŗ¼ÓČė×ćĮæµÄ3mol?L£1H2SO4£¬³ä·ÖÕńµ“”£ | ѳʷȫ²æČܽā |
| ²½Öč2£ŗȔɣŠķČÜŅŗÓŚŹŌ¹ÜÖŠ£¬ÖšµĪ¼ÓČė0.01 mol?L£1ĖįŠŌKMnO4ČÜŅŗ | Čē¹ū×ĻŗģÉ«ĶŹČ„£¬ĖµĆ÷ŹŌŃłÖŠÓŠFeO£» |


 Ó¦ÓĆĢā×÷Ņµ±¾ĻµĮŠ“š°ø
Ó¦ÓĆĢā×÷Ņµ±¾ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®½«FeCl3ČÜŅŗ¼ÓČČÕōøɵƵ½FeCl3¹ĢĢå |
| B£®ĻņFe(NO3)2ČÜŅŗÖŠ¼ÓÉŁĮæŃĪĖį£¬ĪŽĆ÷ĻŌĻÖĻó |
| C£®ĻņĒāŃõ»ÆĆ¾Šü×ĒŅŗÖŠµĪ¼ÓFeCl3ČÜŅŗ£¬ĪŽĆ÷ĻŌĻÖĻó |
| D£®ĻņFeSO4ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ£¬ĻČ³öĻÖ°×É«³Įµķ£¬×īÖÕ³Įµķ×Ŗ»Æ³ÉŗģŗÖÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā

| 25”ꏱ | pHÖµ |
| ±„ŗĶH2SČÜŅŗ | 3.9 |
| SnS³ĮµķĶźČ« | 1.6 |
| FeSæŖŹ¼³Įµķ | 3.0 |
| FeS³ĮµķĶźČ« | 5.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
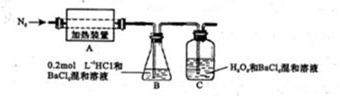
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
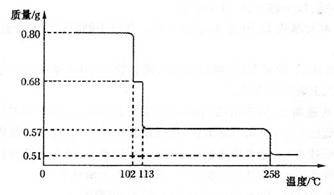
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H2S | B£®S | C£®FeS | D£®FeCl2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®a/2 mol | B£®2a mol | C£®0.100 a mol | D£®(a + 0.100) mol |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com