
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质, C、F是无色无味的气体,H是白色沉淀,.
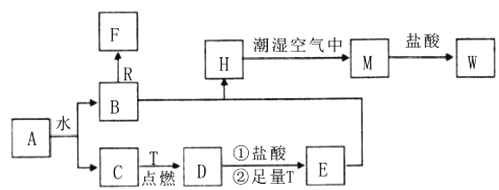
(1)H在潮湿空气中变成M的实验现象是______________,化学方程式为________。
(2)A和水反应生成B和C的离子方程式为___________________________,由此反应可知A有作为_________的用途。
(3)步骤①的离子方程式_________________________,步骤②后的离子方程式___________________请写出检验W溶液中主要阳离子所需要的试剂:_____。
(4)B和R在溶液中反应生成F的离子方程式为_____________________
【答案】白色沉淀迅速变为灰绿色,最终变为红褐色 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑ 供氧剂 Fe3O4+8H+ = Fe2++2Fe3++ 4H2O Fe + 2Fe3+ =3Fe2+ KSCN 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
依据转化关系和反应条件,A为淡黄色固体且能与水反应,所以A为Na2O2,则C为O2,B为NaOH;R是地壳中含量最多的金属,则R为Al,Al可以与NaOH反应产生无色无味的气体F,则F为H2;T为生活中使用最广泛常的金属单质,则T为Fe;Fe在氧气中燃烧生成Fe3O4,则D为Fe3O4;D与盐酸反应再与铁反应生成E为FeCl2,FeCl2结合NaOH反应生成白色沉淀Fe(OH)2,则H为Fe(OH)2,Fe(OH)2与潮湿的空气反应生成Fe(OH)3,则M为Fe(OH)3,M与盐酸反应会生成FeCl3,则W为FeCl3,再根据各物质的性质分析作答。
根据上述分析可知:
(1)H在潮湿空气中变成M的实质是Fe(OH)2转化为Fe(OH)3的过程,其实验现象为白色沉淀迅速变为灰绿色,最终变为红褐色,发生的化学方程式为:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3,
故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3;
(2)A为Na2O2,与水反应的离子方程式为:2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑;Na2O2可与水或二氧化碳制备氧气,故可作为供氧剂,
故答案为:2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑;供氧剂;
(3)D为Fe3O4,D与盐酸反应会生成氯化铁与氯化亚铁和水,其离子方程式为:Fe3O4+8H+ = Fe2++2Fe3++ 4H2O;再加入足量单质铁以后,溶液中的Fe3+会被还原为Fe2+,其离子方程式为:Fe + 2Fe3+ =3Fe2+;W为FeCl3,Fe3+可使KSCN溶液变红,则检验W溶液中主要阳离子所需要的试剂为KSCN溶液,
故答案为:Fe3O4+8H+ = Fe2++2Fe3++ 4H2O;Fe + 2Fe3+ =3Fe2+;KSCN;
(4)B为NaOH,R为Al,则两者在溶液中反应生成F(H2)的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρgcm-3,溶质的质量分数为![]() ,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
A. ![]()
B. ![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5![]()
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理具有极为广泛的应用,请回答下列问题:
(1)电镀是防止金属腐蚀的重要方法,铁制品表面上镀铜的装置示意图如图所示:
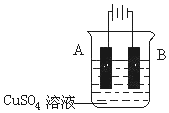
①A电极对应的金属是__________(写元素名称)。
②电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为a g,则电镀时电路中通过的电子为_________mol。
(2)工业上常用电解熔融氯化镁获得金属镁,若电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率,写出生成MgO 的化学方程式_________________。
(3)“镁-次氯酸盐”燃料电池的装置如图所示:
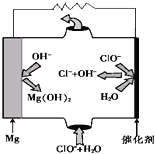
①该电池的正极反应式为__________________。
②若用该电池为电源,用惰性电极电解CuSO4溶液,电解一段时间后,向电解液中加入0.1mol Cu2(OH)2CO3,恰好使溶液恢复到电解前的浓度和pH。电解过程产生的气体体积(在标准状况下)为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 稀H2SO4 滴在铁片上:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B. 稀盐酸滴在碳酸钙上:CO32―+2H+![]() CO2↑+H2O
CO2↑+H2O
C. 硫酸与氢氧化钡溶液混合:Ba2++SO42-![]() BaSO4↓
BaSO4↓
D. 氧化铜与盐酸反应:CuO +2H+![]() Cu2++H2O
Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能说明亚硝酸是弱电解质的是( )
A. 用![]() 溶液做导电试验,灯光较暗
溶液做导电试验,灯光较暗
B. ![]() 是共价化合物
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:
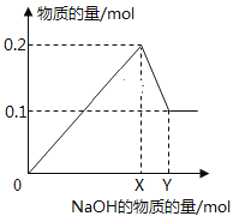
(1)O-X段反应的离子方程式为:________________________,
(2)X-Y段反应的离子方程式为_________________________
(3)生成Mg(OH)2的质量为___________________g;
(4)X=________________;Y=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com