
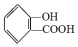
 ,
,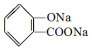 ;请写出将
;请写出将 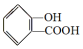 转化为
转化为 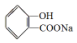 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→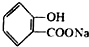 +H2O+CO2↑.
+H2O+CO2↑.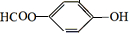
 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是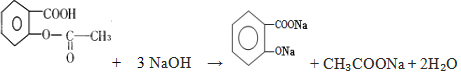 .
. 分析 (1)酚-OH、-COOH均反应生成 ,将
,将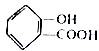 转化为
转化为 ,只有-COOH反应;
,只有-COOH反应;
(2)①能发生银镜反应,含-CHO;
②能与氯化铁溶液显色,含酚-OH;
③核磁共振氢谱1:2:2:1,含4种H;
④能够水解,则含HCOO-结构;
(3) 中-COOH、-COOC-及水解生成的酚-OH均与NaOH反应.
中-COOH、-COOC-及水解生成的酚-OH均与NaOH反应.
解答 解:(1)酚-OH、-COOH均反应生成 ,则将水杨酸与Na或NaOH或碳酸钠溶液作用,可以生成
,则将水杨酸与Na或NaOH或碳酸钠溶液作用,可以生成 ;
;
将 转化为
转化为 ,只有-COOH反应,反应为
,只有-COOH反应,反应为 +NaHCO3→
+NaHCO3→ +H2O+CO2↑,
+H2O+CO2↑,
故答案为:Na或NaOH或碳酸钠; +NaHCO3→
+NaHCO3→ +H2O+CO2↑;
+H2O+CO2↑;
(2)①能发生银镜反应,含-CHO;
②能与氯化铁溶液显色,含酚-OH;
③核磁共振氢谱1:2:2:1,含4种H;
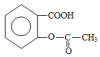
④能够水解,则含HCOO-结构,则符合条件的同分异构体为 ,
,
故答案为: ;
;
(3) 中-COOH、-COOC-及水解生成的酚-OH均与NaOH反应,则反应为
中-COOH、-COOC-及水解生成的酚-OH均与NaOH反应,则反应为 ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意结构与性质的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,棕黄色
,棕黄色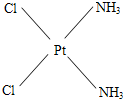 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
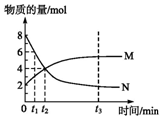 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )| A. | 化学方程式:2N?M | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,M的浓度是N浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 | |
| B. | 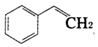 中所有原子可能共平面 中所有原子可能共平面 | |
| C. | 1 mol苹果酸(HOOCCHOHCH2COOH)可与3mol NaHCO3发生反应 | |
| D. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com