
某同学清洗银镜实验后试管内壁上的银并探究其中的反应原理,进行下列实验。
(1)用稀硝酸可以清洗试管内壁上的银,反应的化学方程式为______________。
(2)为消除(1)中所产生的污染问题,改为如下实验。
| 实验编号 | 操作 | 现象 |
| Ⅰ |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a |
①该同学由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能性。他的操作及现象是:取实验Ⅰ所得液体于试管中,______________;
②经查阅资料,发现:实验Ⅰ中银镜溶解后经一系列反应,最后产物为Ag,但是因为颗粒很小(直径在1~100 nm 间)分散在液体中,肉眼无法识别。该同学设计实验,证实了a中存在直径在1~100 nm间的颗粒。他的操作及现象是:________________;
③写出实验Ⅰ的化学方程式:______________。
(3)进一步探究银的化合物在H2O2分解反应中的作用,进行如下实验。
| 实验 编号 | 操作 | 现象 |
| Ⅱ |
| 振荡,溶液无明显现象 |
| Ⅲ |
| 剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体 |
①实验Ⅱ的目的是____________;
根据实验Ⅲ的现象提出假设:
假设1:Ag2O在H2O2分解反应中作氧化剂;
假设2:Ag2O在H2O2分解反应中作催化剂。
②若假设1成立,请写出该反应的化学方程式:______________;
③结合所给试剂,请设计一个简单的实验证明假设1,并将表格填写完整。
可选试剂:1 mol·L-1盐酸、0.1 mol·L-1氨水、1 mol·L-1 NaOH溶液
| 实验步骤和操作 | 实验现象及结论 |
| 取3 mL 10% H2O2在试管中,加入少量Ag2O,充分反应后,__________ |
科目:高中化学 来源: 题型:
下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是
A.同周期元素的原子半径随着核电荷数的增大而增大
B.同主族元素的原子半径随着核电荷数的增大而增大
C.同周期元素的第一电离能随着核电荷数的增大而增大
D.同主族元素的第一电离能随着核电荷数的增大而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH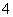 )分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
)分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。

(1)装置Ⅰ中产生气体的化学方程式为________________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是__________________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为__________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
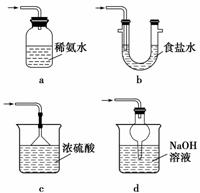
(4)证明NaHSO3溶液中HSO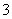 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
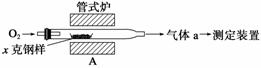
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2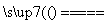 1________+3________。
1________+3________。
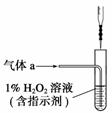
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
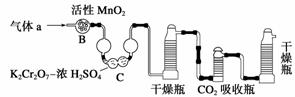
①气体a通过B和C的目的是_______________________________________________。
②计算钢样中碳的质量分数,应测量的数据是___________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
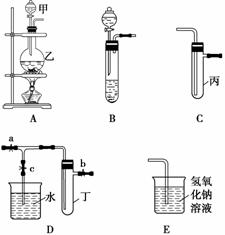
(1)实验室将B、C、E相连后,以浓盐酸和________(填写名称)为原料可制取Cl2,为接下来研究氯气的化学性质做准备。
(2)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象及结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
请你评价:
实验Ⅰ推出相应结论是否合理?________________。若不合理,请说明理由(若合理,则无需填写此空):______________________。
实验Ⅱ推出相应的结论是否合理?______________若不合理,请说明理由(若合理,无需填写此空):____________________。
(3)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱。A中反应的离子方程式为________________________,丙中应放入的试剂是____________。
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2,欲用D装置验证NO2与水的反应,其操作步骤为先关闭止水夹________,再打开止水夹c,使烧杯中的水进入试管丁的操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、Cl-、N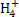 、H+四种离子,下列说法不正确的是( )
、H+四种离子,下列说法不正确的是( )
A.若溶液中c(N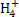 )=c(Cl-),则该溶液一定显中性
)=c(Cl-),则该溶液一定显中性
B.若溶液中c(N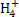 )>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2O
)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2O
C.若溶液中c(Cl-)>c(N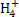 )>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl
)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl
D.若溶液中c(Cl-)>c(H+)>c(N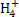 )>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl
)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2====2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是( )
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2====2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是( )
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3溶于盐酸生成CO2:CaCO3+2HCl===CaCl2+CO2↑+H2O。则下列说法中正确的是( )
A.该反应的离子方程式为CO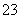 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
B.与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大
C.CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其Ksp增大
D.CaCO3与盐酸按物质的量之比1∶1恰好完全反应,所得溶液中c(H+)+c(Ca2+)=c(OH-)+2c(CO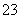 )+c(HCO
)+c(HCO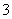 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com