
 (1)利用N2和H2可以实现NH3的工业和成,而氨又可以进一步制备硝酸.已知:
(1)利用N2和H2可以实现NH3的工业和成,而氨又可以进一步制备硝酸.已知:分析 (1)由已知热化学方程式根据盖斯定律构造目标热化学方程式,已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得;
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③化学平衡三行计算列式计算,反应速率v=$\frac{△c}{△t}$,进行计算.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2生成物氨气的量增加,平衡正移,故T2<T1,
故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,
故答案为:c;
③化学平衡三行计算列式计算,
N2(g)+3H2(g)?2NH3(g)
起始量(mol)1 3 0
变化量(mol)0.6 3×60% 1.2
平衡量(mol) 0.4 1.2 1.2
反应速率v=$\frac{△c}{△t}$=$\frac{\frac{1.2mol}{1L}}{5min}$=0.24mol/(L.min).
点评 本题考查了热化学方程式书写、影响平衡移动的因素、平衡图象、化学平衡计算等,难度中等,注意掌握三段式解题法与盖斯定律应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且乙的压强大 | |
| C. | 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 图④表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为b |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 久置的浓硝酸显黄色 | |
| B. | 铜片放入硝酸中,溶液变蓝 | |
| C. | 碳单质放入浓硝酸中产生大量红棕色的气体 | |
| D. | 浓硝酸敞口放置在空气中,质量会减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
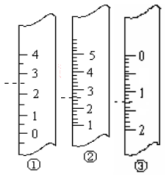 (1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL
(1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.23 g NaCl固体 | B. | 用胶头滴管取约1 mL溶液 | ||
| C. | 向小试管中加入100 mL稀盐酸 | D. | 用50 mL量筒量取30.12 mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2是复盐,一种特殊的混合物 | |
| B. | b≤0.5a时,发生的离子反应为Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O | |
| C. | 当0.5a<b≤2a时可能发生的离子反应为2H++Fe3++2Ba2++2SO42-+5OH-═2BaSO4↓+2Fe(OH)3↓+2H2O | |
| D. | 当2a<b≤3a时可能发生的离子反应为NH4++Fe3++H++3SO42-+3Ba2++5OH-═3BaSO4↓+Fe(OH)3↓+NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com