
【题目】下列说法不正确的是![]()
![]()
A.煤的气化就是把煤转化为可燃性气体的过程。在高温下,煤和水蒸气作用得到CO、![]() 、
、![]() 等气体
等气体
B.糖类、油脂、蛋白质在一定条件下均能水解
C.向蛋白质溶液中加入饱和硫酸钠溶液,先产生白色沉淀,加水后又重新溶解
D.淀粉溶液中滴加硫酸,加热水解后,往水解液中滴加![]() 滴新制氢氧化铜,加热,无红色沉淀出现,原因可能是硫酸未完全被中和
滴新制氢氧化铜,加热,无红色沉淀出现,原因可能是硫酸未完全被中和
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: X(g)+2Y(g) ![]() 3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,Y 的正反应速率和 Z 的逆反应速率相等
B. 达到化学平衡状态时,X、Y、Z 的浓度之比为 1 : 2 : 3
C. 达到化学平衡状态时,反应放出的总热量一定小于 a kJ
D. 0.2 mol X 和 0.2 mol Y 充分反应生成 Z 的物质的量一定小于 0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3.2g某气体(分子式:RH4),摩尔质量为16 g·mol-1,则:
(1)R的相对原子质量为____________
(2)该气体所含分子数为___________________NA。
(3)该气体在标准状况下的体积约为___________________L。
(4)其中氢原子数目与___________ gNH3中的氢原子数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用下列方法制取的,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,试回答下列问题:
MnCl2+Cl2↑+2H2O,试回答下列问题:
(1)该反应是氧化还原反应吗?__________(填“是”或“否”),如果是氧化还原反应,请指出__________是氧化剂,______________是还原剂,____________是氧化产物,______________是还原产物,根据上述氧化还原反应判断氧化性:__________>__________;还原性:__________>____________。
(2)写出该反应的离子方程式______________________________。
(3)用双线桥法标出该反应电子转移的方向和数目__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示装置所表示的实验中,没有发生氧化还原反应的是
|
|
|
|
A.蘸有浓盐酸和浓氨水的玻璃棒靠近 | B.铝丝伸入硫酸铜溶液中 | C.测定空气中氧气含量 | D.向蔗糖中加入浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文物是人类宝贵的历史文化遗产,我国文物资源丰富,但保存完好的铁器比青铜器少得多,研究铁质文物的保护意义重大。

(1)铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是________。
(2)已知:
ⅰ.铁质文物在潮湿的土壤中主要发生吸氧腐蚀,表面生成疏松的FeOOH;
ⅱ.铁质文物在干燥的土壤中表面会生成致密的Fe2O3,过程如下。
![]()
①写出ⅰ中,O2参与反应的电极反应式和化学方程式:________、________。
②若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为________。
③结合已知信息分析,铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重的主要原因是________。
(3)(资料1)Cl–体积小穿透能力强,可将致密氧化膜转化成易溶解的氯化物而促进铁质文物继续锈蚀。
(资料2)Cl–、Br–、I–促进铁器皿继续锈蚀的能力逐渐减弱。
①写出铁质文物表面的致密氧化膜被氯化钠破坏的化学方程式________。
②结合元素周期律解释“资料2”的原因是________。
(4)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使Cl-渗出后,取最后一次浸泡液加入试剂 ________(填化学式)检验脱氯处理是否达标。
(5)经脱氯、干燥处理后的铁质文物再“覆盖”一层透明的高分子膜可以有效防止其在空气中锈蚀。下图为其中一种高分子膜的片段:
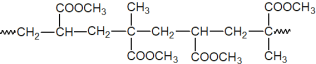
该高分子的单体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com