
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
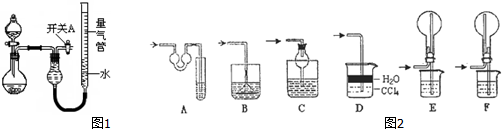
分析 (1)分液漏斗加液时要注意内外空气相通,压强相等,液体才能顺利流下;
(2)实验Ⅰ装置中有空气,一氧化氮与空气反应生成二氧化氮,二氧化氮溶于水;
(3)SO2气体通入溴水溶液中发生反应生成硫酸和溴化氢;
(4)氨气极易溶于水,量气管中的液体应该不含水且不与氨气反应,最好用煤油;极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
(5)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
(6)实验Ⅳ,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数.
解答 解:(1)分液漏斗用于气体发生器中控制加液,也常用于互不相溶的几种液体的分离,加液时要注意内外空气相通,压强相等,液体才能顺利流下,具体操作为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加,
故答案为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加;
(2)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置Ⅰ中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验I收集并测量NO气体的体积来探究铜样品的纯度,
故答案为:不可行;
(3)SO2气体通入溴水溶液中发生反应生成硫酸和溴化氢,反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(4)氨气为碱性气体,极易溶于水,量气管中的液体应该不含水且不与氨气反应,浓NaOH溶液、氨水、氯化铵溶液中含有水,氨气被水吸收,而氨气不溶于煤油,所以量气管中液体最好是煤油,故选c;
A、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸;故A正确;
B、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸;故B不正确;
C、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故C正确.
D、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故D正确;
E、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故E错误;
F、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故F正确;
所以能防倒吸的吸收装置有ACDF,
故答案为:c;ACDF;
(5)根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差,
故答案为:使量气管两端液面相平;
(6)第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=$\frac{(346.3-10.0)+(345.7-10)}{2}$=336.0mL=0.336L
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×22.4L
x 0.336L
$\frac{3×22.4L}{0.336L}$=$\frac{54g}{x}$,解之得:x=0.27g
铝的质量分数=$\frac{0.27g}{1.0g}$=27.0%,
故答案为:27.0%.
点评 本题考查了物质性质实验方案的设计方法,题目难度中等,明确常见物质的性质及实验操作基本方法为解答关键,试题侧重考查学生的分析、理解能力及化学实验、化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| 氨水体积/mL | 40 | V1 | 30 | 20 |
| 盐酸体积/mL | 20 | 60-V1 | 30 | 40 |
| A. | ①所得溶液中,c(NH4+)>c(C1-)>c(NH2•H2O)>c(OH-)>c(H+) | |
| B. | 若②所得溶液pH=7,则c(NH4+)=c(C1-)=1×10-7mo1•L-1 | |
| C. | ③所得溶液中.c(H+)-c(OH-)=c(NH3•H2O) | |
| D. | ④所得溶液中,c(C1-)=2c(NH3•H2O)+2c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3粉末(NaHCO3),加热直至固体质量不再减少 | |
| B. | NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体 | |
| C. | CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中 | |
| D. | H2(HCl),将气体通入碱石灰中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com