
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
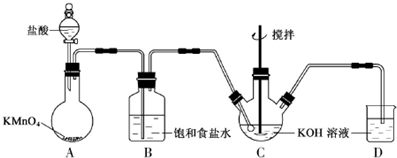
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X只能形成一种氢化物 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(X)>r(Y) | |
| C. | 化合物Q中存在两种类型的共价键 | |
| D. | X与Z形成的化合物在熔融状态下能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.
,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.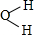 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
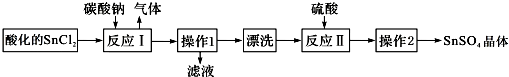
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+═CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次 | |
| D. | 操作1为过滤,操作2为盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com