
 ;
; ;
;分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;
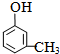
(2)醇可以和金属钠反应,但是不和氢氧化钠反应;取1.08g C7H8O的物质的量=$\frac{1.08g}{108g/mol}$=0.01mol,与足量饱和溴水完全反应能生成3.45g白色沉淀,有机物为甲基苯酚,根据碳原子守恒知,白色沉淀的物质的量是0.01mol,则白色沉淀的摩尔质量是345g/mol,有机物的式量和白色沉淀的式量相差237,故苯环中有3个H原子给溴原子取代,溴原子取代酚羟基的邻对位,故有机物为间甲基苯酚;
(3)根据溴乙烷在碱溶液中水解,碘化钠和溴单质反应生成碘单质,氯化钠不能除去溴单质进行判断.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: ,故答案为:
,故答案为: ;
;
(2)芳香族化合物C7H8O可以是苯甲醇、甲基苯风等物质,其中)醇可以和金属钠反应,但是不和氢氧化钠反应,取1.08g C7H8O的物质的量=$\frac{1.08g}{108g/mol}$=0.01mol,与足量饱和溴水完全反应能生成3.45g白色沉淀,有机物为甲基苯酚,根据碳原子守恒知,白色沉淀的物质的量是0.01mol,则白色沉淀的摩尔质量是345g/mol,有机物的式量和白色沉淀的式量相差237,故苯环中有3个H原子给溴原子取代,溴原子取代酚羟基的邻对位,故有机物为间甲基苯酚,结构简式为: ,
,
故答案为:C6H5-CH2OH; ;
;
(3)欲除去溴乙烷中的少量杂质Br2,
a.NaI和溴单质反应,但生成的碘单质会混入,故a错误;
b.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故b错误;
c.溴单质和NaHSO3 溶液发生氧化还原反应,可以除去溴单质,故c正确;
d.KCl不能除去溴单质,故d错误;
故答案为:c.
点评 本题考查了电子式的书写、有机物的推断等,难度中等,是对基础知识的综合运用,注意掌握官能团的性质是关键.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:解答题
 实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法.所用装置如图.
实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法.所用装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)?4NO2(g)+O2(g),△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)?4NO2(g)+O2(g),△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )| A. | 10min时,反应达到平衡 | |
| B. | 该温度下反应的平衡常数为8 | |
| C. | 0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 | |
| D. | 曲线a表示NO2的物质的量随反应时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 | |
| B. | 只有酸电离才能提供氢离子 | |
| C. | 电离时能生成氢氧根离子的化合物叫做碱 | |
| D. | 所有的盐电离时都生成金属离子和酸根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 相邻的原子之间的相互作用叫做化学键 | |
| B. | 金属和非金属元素的相互化合,都能形成离子键 | |
| C. | 钠元素的原子半径比其阳离子半径大 | |
| D. | 氯元素的原子半径比其阴离子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p轨道上有3个不成对电子的元素 | |
| B. | 最外层电子数是次外层电子数的3倍的元素 | |
| C. | 形成化合物种类最多的元素 | |
| D. | 周期数等于族序数等于次外层电子数的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com