
常温下,两种气态烃组成的混合气体0.1 mol,完全燃烧得0.15 mol CO2和3.6 g H2O,下列关于该混合气体的说法正确的是
①一定有甲烷 ②可能有乙烷 ③一定没有乙烷 ④可能有乙烯
A.①② B.①②④ C.①③④ D.②④
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
由两种烃组成的混合气体2 L与足量的氧气充分反应后生成CO2 5 L、H2O 6 L(所有体积都在120℃测定),则这两种混合气体的不可能组成是 ( )
A.CH4、C4H8 B.C2H4、C4H10 C.C2H4、C3H8 D.C2H6、C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:

下列说法不正确的是
A.①和②变化过程中都会放出热量
B.氯原子吸引电子的能力强于钠原子和氢原子
C.①和②中的氯原子均得到1个电子达到8电子稳定结构
D. NaCl中含有离子键,HCl中含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积固定的密闭容器中发生反应:2NO+O2 
 2NO2,则达到平衡状态的标志是
2NO2,则达到平衡状态的标志是
①单位时间内生成n molO2的同时,生成2n mol NO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②④⑥ C.①③④⑤ D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
能证明某烃分子里只含有一个碳碳双键的事实是
A.该烃分子里碳氢原子个数比为1: 2
B.该烃能使酸性KMnO4溶液褪色
C.该烃完全燃烧生成的CO2和H2O的物质的量相等
D.该烃容易与溴水发生加成反应,且1mol该烃完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是__________。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:
在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向
进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是:
。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
 反应A:
反应A:
已知:

反应Ⅰ中反应物总键能 生成物总键能。(填大于、等于或小于)
反应Ⅱ是_________反应。(填“吸热”或“放热”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量 之间关系如图所示。则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
之间关系如图所示。则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
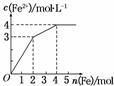 ( )
( )
A.3∶1 B.1∶2
C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,有一种细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐。发生的反应为:
4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是________,检验反应后溶液中含有Fe3+的方法_______________________________________________________
________________________________________________________________________。
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
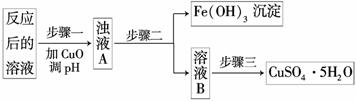
 已知Fe(OH3)、Cu(OH)2的溶度积Ksp分别为:2.6×10-39、2.2×10-20,请解释加入CuO能除去CuSO4溶液中Fe3+的原因________________________________________。
已知Fe(OH3)、Cu(OH)2的溶度积Ksp分别为:2.6×10-39、2.2×10-20,请解释加入CuO能除去CuSO4溶液中Fe3+的原因________________________________________。
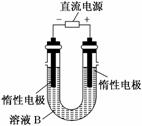
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右侧电极的反应式是__________________________,
若将右侧电极换为铁,则铜析出在________电极上(“左侧”或“右侧”)。
(4)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)===6Cu(s)+SO2(g) ΔH=a
已知:①2Cu(s)+1/2O2(g)===Cu2O(s)
ΔH=-12 kJ·mol-1
②2Cu(s)+S(s)===Cu2S(s) ΔH=-79.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1
则a=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com